Scheikunde
De vorming van een oplossing is een voorbeeld van een spontaan proces, een proces dat onder bepaalde omstandigheden plaatsvindt zonder dat daarvoor energie van een externe bron nodig is. Soms roeren we een mengsel om het oplossingsproces te versnellen, maar dit is niet nodig; er zou een homogene oplossing ontstaan als we maar lang genoeg wachtten. Het onderwerp spontaniteit is van cruciaal belang voor de studie van de chemische thermodynamica en wordt in een later hoofdstuk van deze tekst uitvoeriger behandeld. Voor de bespreking van dit hoofdstuk volstaat het twee criteria te beschouwen die de spontane vorming van een oplossing bevorderen, maar niet garanderen:
- een afname van de inwendige energie van het systeem (een exotherme verandering, zoals besproken in het vorige hoofdstuk over thermochemie)
- een toename van de wanorde in het systeem (wat duidt op een toename van de entropie van het systeem, zoals u zult leren in het latere hoofdstuk over thermodynamica)
In het proces van oplossen treedt vaak, maar niet altijd, een inwendige energieverandering op doordat warmte wordt geabsorbeerd of wordt geëvolueerd. Bij de vorming van een oplossing treedt altijd een toename van wanorde op.
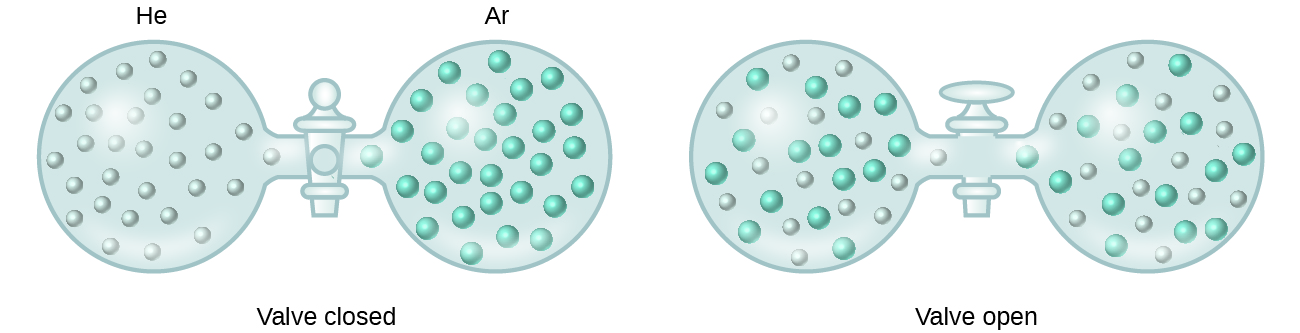
Wanneer de sterkte van de intermoleculaire aantrekkingskrachten tussen de opgeloste en de oplosmiddelsoorten in een oplossing niet verschilt van die welke aanwezig is in de gescheiden componenten, wordt de oplossing gevormd zonder begeleidende energieverandering. Een dergelijke oplossing wordt een ideale oplossing genoemd. Een mengsel van ideale gassen (of gassen zoals helium en argon, die het ideale gedrag dicht benaderen) is een voorbeeld van een ideale oplossing, aangezien de entiteiten waaruit deze gassen bestaan geen significante intermoleculaire attracties ondervinden.
Wanneer houders van helium en argon met elkaar worden verbonden, vermengen de gassen zich spontaan ten gevolge van diffusie en vormen een oplossing (figuur 2). De vorming van deze oplossing gaat duidelijk gepaard met een toename van de wanorde, aangezien de helium- en argonatomen een volume innemen dat tweemaal zo groot is als het volume dat elk van hen innam vóór de menging.
Ideale oplossingen kunnen zich ook vormen wanneer structureel gelijksoortige vloeistoffen worden gemengd. Zo vormen mengsels van de alcoholen methanol (CH3OH) en ethanol (C2H5OH) ideale oplossingen, evenals mengsels van de koolwaterstoffen pentaan, C5H12, en hexaan, C6H14. Het plaatsen van methanol en ethanol, of pentaan en hexaan, in de bollen van figuur 2 zal resulteren in dezelfde diffusie en daaropvolgende vermenging van deze vloeistoffen als wordt waargenomen voor de gassen He en Ar (zij het in een veel langzamer tempo), wat oplossingen oplevert met geen significante verandering in energie. In tegenstelling tot een gasmengsel ondervinden de componenten van deze vloeistof-vloeistof-oplossingen wel degelijk intermoleculaire aantrekkingskrachten. Maar aangezien de moleculen van de twee stoffen die worden gemengd structureel sterk op elkaar lijken, zijn de intermoleculaire aantrekkingskrachten tussen gelijksoortige en ongelijksoortige moleculen in wezen gelijk, zodat het ontbindingsproces geen noemenswaardige energietoename of -afname met zich meebrengt. Deze voorbeelden illustreren hoe diffusie alleen de drijvende kracht kan leveren die nodig is om de spontane vorming van een oplossing te veroorzaken. In sommige gevallen echter kan de relatieve grootte van de intermoleculaire aantrekkingskrachten tussen opgeloste en oplosmiddelsoorten het oplossen verhinderen.
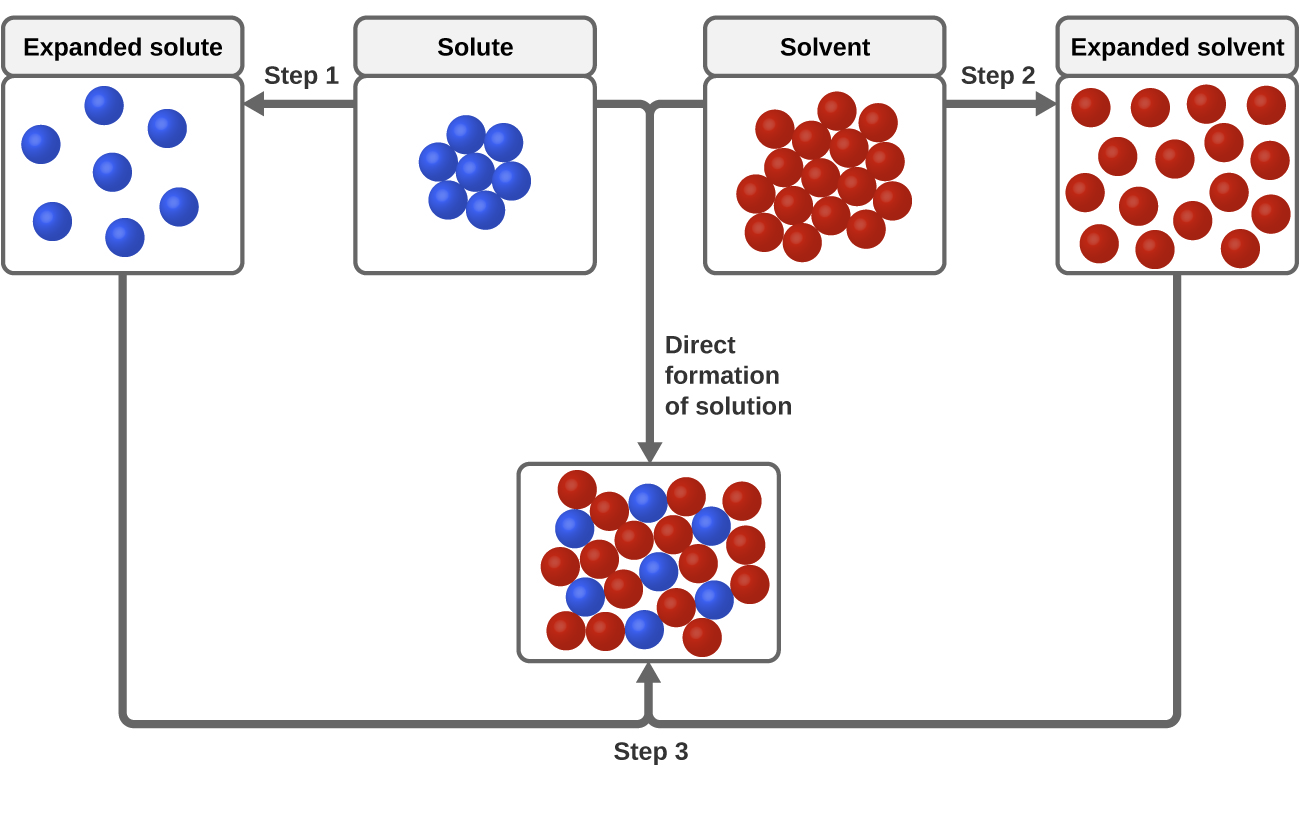
Drie soorten intermoleculaire aantrekkingskrachten zijn relevant voor het oplossingsproces: oplosmiddel-oplosmiddel, oplosmiddel-oplosmiddel, en oplosmiddel-oplosmiddel. Zoals geïllustreerd in figuur 3, kan de vorming van een oplossing worden gezien als een stapsgewijs proces waarin energie wordt verbruikt om de aantrekkingskrachten tussen oplosmiddel en oplosmiddel te overwinnen (endotherme processen) en wordt vrijgegeven wanneer de aantrekkingskrachten tussen oplosmiddel en oplosmiddel tot stand zijn gebracht (een exotherm proces dat solvatatie wordt genoemd). De relatieve grootte van de energieveranderingen die met deze stapsgewijze processen gepaard gaan, bepaalt of het oplossingsproces als geheel energie zal vrijmaken of absorberen. In sommige gevallen worden geen oplossingen gevormd omdat de energie die nodig is om de opgeloste en de oplosbare stoffen te scheiden zoveel groter is dan de energie die vrijkomt bij de solvatatie.
Zo zullen bijvoorbeeld bak- en braadolie en water niet in noemenswaardige mate met elkaar mengen om oplossingen te verkrijgen (figuur 4). Waterstofbinding is de dominante intermoleculaire aantrekkingskracht in vloeibaar water; de apolaire koolwaterstofmoleculen van spijsoliën kunnen geen waterstofbinding aangaan, maar worden bijeengehouden door dispersiekrachten. Om een olie-water oplossing te vormen zou men de zeer sterke waterstofbinding in water moeten overwinnen, evenals de aanzienlijk sterke dispersiekrachten tussen de relatief grote oliemoleculen. En aangezien de polaire watermoleculen en de apolaire oliemoleculen geen zeer sterke intermoleculaire aantrekkingskracht ondervinden, zou er zeer weinig energie vrijkomen bij de solvatatie.

Een mengsel van ethanol en water daarentegen zal in elke verhouding mengen en een oplossing opleveren. In dit geval zijn beide stoffen in staat tot waterstofbinding, en dus is het oplossingsproces voldoende exotherm om de endotherme scheidingen van opgeloste en oplosmiddelmoleculen te compenseren.
Zoals aan het begin van deze module is opgemerkt, wordt spontane vorming van oplossingen bevorderd, maar niet gegarandeerd, door exotherme oplossingsprocessen. Hoewel veel oplosbare verbindingen inderdaad oplossen met afgifte van warmte, lossen sommige endotherm op. Ammoniumnitraat (NH4NO3) is zo’n voorbeeld en wordt gebruikt om instant cold packs te maken voor de behandeling van verwondingen zoals die welke in figuur 5 is afgebeeld. Een dunwandige plastic zak met water wordt afgesloten in een grotere zak met vast NH4NO3. Wanneer de kleinere zak wordt gebroken, vormt zich een oplossing van NH4NO3, die warmte absorbeert uit de omgeving (het verwonde gebied waarop de zak wordt aangebracht) en een koud kompres vormt dat de zwelling vermindert. Endotherme oplossingen zoals deze vereisen een grotere energie-input om de opgeloste soorten te scheiden dan wordt teruggewonnen wanneer de opgeloste stoffen worden opgelost, maar ze zijn niettemin spontaan als gevolg van de toename in wanorde die gepaard gaat met de vorming van de oplossing.


Bekijk deze korte video waarin endotherme en exotherme oplossingsprocessen worden geïllustreerd.
Key Concepts and Summary
Een oplossing wordt gevormd wanneer twee of meer stoffen fysisch met elkaar versmelten tot een mengsel dat homogeen is op moleculair niveau. Het oplosmiddel is de meest geconcentreerde component en bepaalt de fysische toestand van de oplossing. De opgeloste stoffen zijn de andere componenten die gewoonlijk aanwezig zijn in concentraties die lager zijn dan die van het oplosmiddel. Oplossingen kunnen endotherm of exotherm gevormd worden, afhankelijk van de relatieve grootte van de intermoleculaire aantrekkingskrachten van de opgeloste stof en het oplosmiddel. Ideale oplossingen vormen zich zonder noemenswaardige verandering in energie.
Chemistry End of Chapter Exercises
- Waarin verschillen oplossingen van samenstellingen?
- Welke van de belangrijkste eigenschappen van oplossingen zien we in de oplossingen van K2Cr2O7 in figuur 1?
- Wanneer KNO3 in water wordt opgelost, is de resulterende oplossing aanzienlijk kouder dan het water oorspronkelijk was.
(a) Is het oplossen van KNO3 een endotherm of een exotherm proces?
(b) Welke conclusies kun je trekken over de intermoleculaire attracties die bij dit proces betrokken zijn?
(c) Is de resulterende oplossing een ideale oplossing?
- Geef een voorbeeld van elk van de volgende soorten oplossingen:
(a) een gas in een vloeistof
(b) een gas in een gas
(c) een vaste stof in een vaste stof
- Geef aan wat de belangrijkste soorten intermoleculaire attracties zijn in elk van de volgende oplossingen:
(a) De oplossing in figuur 1.
(b) NO(l) in CO(l)
(c) Cl2(g) in Br2(l)
(d) HCl(aq) in benzeen C6H6(l)
(e) Methanol CH3OH(l) in H2O(l)
- Voorspel of elk van de volgende stoffen beter oplosbaar is in water (polair oplosmiddel) of in een koolwaterstof zoals heptaan (C7H16, niet-polair oplosmiddel):
(a) plantaardige olie (apolair)
(b) isopropylalcohol (polair)
(c) kaliumbromide (ionisch)
- Warmte komt vrij bij de vorming van sommige oplossingen; warmte wordt geabsorbeerd bij de vorming van andere oplossingen. Geef een moleculaire verklaring voor het verschil tussen deze twee soorten spontane processen.
- Oplossingen van waterstof in palladium kunnen worden gevormd door Pd-metaal bloot te stellen aan H2-gas. De waterstofconcentratie in het palladium hangt af van de toegepaste H2-gasdruk, maar op een complexere wijze dan door de wet van Henry kan worden beschreven. Onder bepaalde omstandigheden wordt 0,94 g waterstofgas opgelost in 215 g palladiummetaal.
(a) Bepaal de molariteit van deze oplossing (oplossingsdichtheid = 1,8 g/cm3).
(b) Bepaal de molaliteit van deze oplossing (oplossingsdichtheid = 1,8 g/cm3).
(c) Bepaal het massapercentage waterstofatomen in deze oplossing (oplossingsdichtheid = 1,8 g/cm3).




