Wat is het verschil tussen ionische en covalente bindingen
Alle materie om je heen wordt bij elkaar gehouden door chemische bindingen. Soms worden chemische bindingen verbroken, bijvoorbeeld tijdens een chemische reactie, waarna atomen zich opnieuw binden om andere moleculen te vormen. Er komt altijd energie vrij om bindingen te vormen en er is ook altijd energie nodig om bindingen te verbreken.
Er zijn twee hoofdtypen chemische bindingen: ionische en covalente.
Wat zijn ionische en covalente bindingen?
Atomen binden zich aan elkaar om verbindingen te vormen, omdat ze daarbij een lagere energie bereiken dan ze als afzonderlijke atomen bezitten, en daardoor stabieler worden. Volgens de Wet van Behoud van Energie komt bij de vorming van een nieuwe chemische verbinding bij de chemische reactie een hoeveelheid energie vrij (gewoonlijk in de vorm van warmte) die bijna gelijk is aan het verschil in de hoeveelheid opgeslagen chemische energie tussen de producten en de reactanten. Deze opgeslagen chemische energie van het systeem, of warmte-inhoud, staat bekend als zijn enthalpie.
Een ionische binding wordt gevormd wanneer twee ionen met tegengestelde ladingen onderling elektronen uitwisselen, waarbij een ion een atoom is dat ofwel een elektron heeft verloren ofwel een elektron heeft gewonnen. Ionen die een of meer elektronen verliezen hebben meer protonen dan elektronen, wat betekent dat ze een positieve lading hebben. Dergelijke ionen worden kationen (metalen) genoemd. Aan de andere kant krijgt het ion een negatieve lading als het elektronen wint. Scheikundigen noemen dergelijke ionen anionen (niet-metalen).
Ionische verbindingen zijn doorgaans neutraal. Daarom combineren ionen zich op manieren die hun ladingen neutraliseren.
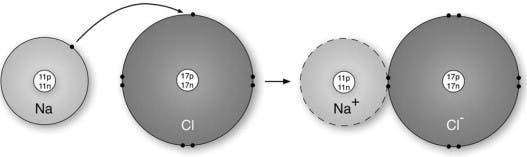
Een schoolvoorbeeld van een ionische verbinding is natriumchloride, ook bekend als keukenzout. Een enkel natriumatoom heeft 11 protonen en 11 elektronen, maar slechts een enkel elektron in zijn buitenste schil (of valentieschil). Chloor bestaat uit 17 protonen en 17 elektronen, en heeft 7 elektronen in zijn buitenste schil. Als de twee atomen reageren, verliest natrium (elektropositief) zijn valentie-elektron aan chloor (elektronegatief). In de resulterende kristalstructuur wordt elk natriumion omgeven door zes chloride-ionen en elk chloride-ion door zes natrium-ionen. Bovendien heeft elk ion een volledige elektronenschil die overeenkomt met het dichtstbijzijnde inerte gas; neon voor een natriumion, argon voor een chloride-ion
Covalente bindingen worden gevormd wanneer atomen of ionen elektronen delen, zodanig dat hun buitenste schillen bezet raken. Covalente bindingen, ook wel moleculaire bindingen genoemd, worden alleen gevormd tussen niet-metaalatomen met een identieke of relatief nauwe elektronegativiteitswaarde. Elektronegativiteit, aangeduid met het symbool χ, is een chemische eigenschap die de neiging van een atoom beschrijft om een gedeeld elektronenpaar (of elektronendichtheid) naar zich toe te trekken.
Het aantal covalente bindingen dat een atoom kan vormen, wordt de valentie van het atoom genoemd. Deze eigenschap vertegenwoordigt de elektronen van een atoom die kunnen deelnemen aan de vorming van chemische bindingen met andere atomen. Het zijn de elektronen die het verst van de kern verwijderd zijn.
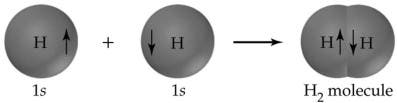
Een goed voorbeeld van een covalente binding is de waterstofmolecule, die wordt gevormd uit twee waterstofatomen, elk met één elektron in hun buitenste schil. Bij de vorming van de binding komt warmte vrij; daarom is deze exotherm. Voor het waterstofmolecuul bedraagt de warmte die vrijkomt bij de vorming, ook bekend als de standaard enthalpieverandering (ΔH°), -435 kJ per mol. Het omgekeerde proces, het verbreken van de H-H binding, vergt 435 kJ per mol, een hoeveelheid die de bindingssterkte wordt genoemd.
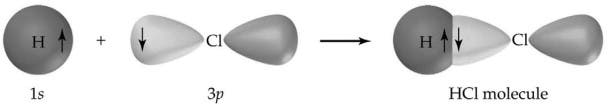
Een ander klassiek voorbeeld van een covalente binding is waterstofchloride (HCl), dat een waterstofhalogenide is. Het chlooratoom heeft 7 atomen in zijn buitenste schil, terwijl waterstof 1 elektron in zijn buitenste schil heeft. Beide combineren perfect, zodat elk atoom zijn valentieschil vult en een zeer stabiel molecuul vormt. Nu zal het HCl-molecuul niet verder reageren met andere chloor- of waterstofatomen.
Verschillen tussen ionische en covalente bindingen
- Covalente bindingen komen in de organische scheikunde veel vaker voor dan ionische bindingen.
- In covalente bindingen delen atomen elektronen, terwijl in ionische bindingen atomen elektronen overdragen.
- De reactiecomponenten van covalente bindingen zijn elektrisch neutraal, terwijl ze bij ionische bindingen beide geladen zijn. Dit verklaart waarom natriumchloride (zout) elektriciteit geleidt wanneer het wordt opgelost – de componenten ervan zijn geladen.
- Ionische bindingen zijn veel sterker dan covalente bindingen.
- Covalente bindingen komen in de natuur veel vaker voor dan ionische bindingen. De meeste moleculen in levende wezens zijn bijvoorbeeld covalent gebonden.
- Covalente bindingen kunnen zich vormen tussen atomen van dezelfde elementen (b.v. H2). Maar ionische bindingen kunnen dit niet.
- Covalente bindingen worden gevormd tussen twee niet-metalen, terwijl ionische bindingen worden gevormd tussen een metaal en een niet-metaal.
- Moleculen gevormd door covalente bindingen hebben een laag smeltpunt, terwijl die met ionische bindingen een hoog smeltpunt hebben. Dezelfde relatie bestaat voor het kookpunt.
- Bij kamertemperatuur zijn covalent gebonden moleculen in verreweg de meeste gevallen vloeistoffen of gassen, terwijl ionische verbindingen vast zijn.
Gelijkenissen tussen ionische en covalente bindingen
- Beide soorten bindingen leiden tot de vorming van stabiele chemische verbindingen.
- Er zijn exotherme reacties (d.w.z. waarbij warmte vrijkomt) nodig om ionische en covalente bindingen tot stand te brengen.
- Bij beide bindingsprocessen zijn valentie-elektronen betrokken.
- Het maakt voor de elektrische lading van een molecuul niet uit of het door ionische of covalente binding tot stand komt: het resultaat is altijd elektrisch neutraal.




