3.3: Subatomaire Deeltjes – Elektronen, Protonen en Neutronen
Identificeren en lokaliseren van de Subatomaire Deeltjes
In 1897 bewees de Britse natuurkundige J. J. Thomson (1856-1940) dat atomen niet de meest basale vorm van materie waren. Bij zijn experimenten maakte hij gebruik van kathodestraalbuizen (CRT). In een vacuümomgeving produceren deze apparaten onzichtbare stralen die uitgaan van een negatieve elektrode (kathode) en doorgaan naar een positieve elektrode (anode). In deze experimenten toonde Thomson aan dat kathodestralen kunnen worden afgebogen door magnetische of elektrische velden, hetgeen erop wijst dat kathodestralen uit geladen deeltjes bestaan. Belangrijker nog, door de mate van afbuiging van de kathodestralen in magnetische of elektrische velden van verschillende sterkte te meten, kon Thomson de verhouding massa/lading van de deeltjes berekenen. Omdat gelijke ladingen elkaar afstoten en tegengestelde ladingen elkaar aantrekken, concludeerde Thomson dat de deeltjes een netto negatieve lading hadden; deze deeltjes worden nu elektronen genoemd. Thomson ontdekte dat de verhouding tussen massa en lading van kathodestralen onafhankelijk is van de aard van de metalen elektroden of het gas, wat suggereerde dat elektronen fundamentele componenten zijn van alle atomen.
In de jaren tien van de vorige eeuw leidden experimenten met röntgenstraling tot de volgende nuttige conclusie: de positieve lading in de kern van elk atoom van een bepaald element is even groot. Met andere woorden, alle atomen van hetzelfde element hebben hetzelfde aantal protonen. Bovendien hebben verschillende elementen een verschillend aantal protonen in hun kern, zodat het aantal protonen in de kern van een atoom kenmerkend is voor een bepaald element. Deze ontdekking was zo belangrijk voor ons begrip van atomen dat het aantal protonen in de kern van een atoom het atoomnummer wordt genoemd. Deze experimenten werden uitgevoerd door Ernest Rutherford. Aan hem wordt toegeschreven dat hij een centrale plaats in het atoom heeft bepaald die nu de kern wordt genoemd.
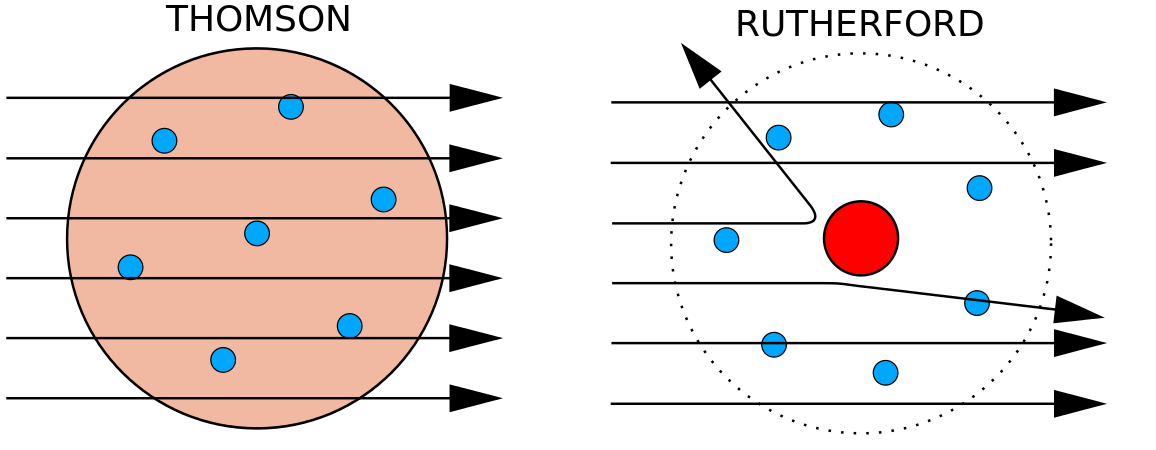
Rutherford was zich ervan bewust dat de protonen zich in dit gebied bevonden. Een van Ernest Rutherfords collega’s, James Chadwick, voerde radioactieve reacties van beryllium uit en bestudeerde deze. Bij het raken van een beryllium kern met alfa deeltjes, werd een neutron deeltje uitgezonden. In 1932 kondigde James Chadwick het bestaan aan van een derde subatomair deeltje, het neutron. Dit deeltje heeft een massa van 1 atomaire massa eenheid, maar heeft geen lading. Na deze ontdekking kwamen de nucleaire wetenschap en technologie onmiddellijk op gang.
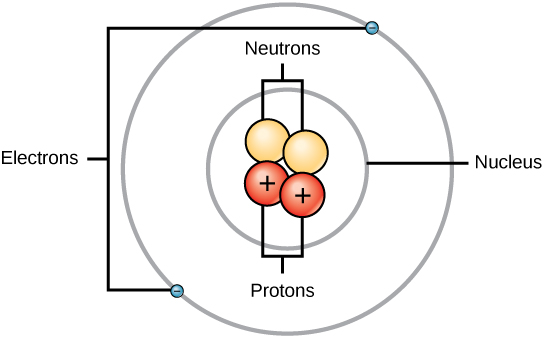
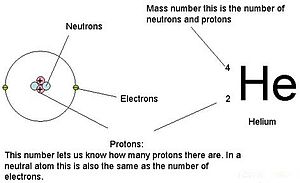
Massa’s voor de drie subatomaire deeltjes kunnen worden uitgedrukt in amu (atomaire massa eenheden) of gram. Om het eenvoudig te houden, gebruiken we de amu-eenheid voor de drie subatomaire deeltjes. Zowel neutronen als protonen hebben een massa van 1 amu elk. Het elektron daarentegen heeft een verwaarloosbare massa van .0005 amu. De massa van dit subatoom wordt niet weergegeven in de decimale massa die wordt weergegeven op het periodiek systeem. Alleen protonen en neutronen dragen bij aan de massa van een atoom.
en:User:Materialscientist)
Voor atomen (neutrale soorten) is het aantal elektronen gelijk aan het aantal protonen. Als gevolg hiervan hebben alle atomen een totale lading van nul. Voor de bespreking van ionen (atomen die elektronen winnen of verliezen) wordt verwezen naar het laatste deel van dit hoofdstuk. Atomen die in neutronen en massa’s verschillen van de tabel worden isotopen genoemd. Deze specifieke soorten zijn te zien in het volgende gedeelte van de tekst.
| Subatomair deeltje | Symbool | Relatieve lading | Locatie | Amu massa |
|---|---|---|---|---|
| Proton | p | +1 | binnen de kern | 1 |
| Neutron | n | 0 | binnen de atoomkern | 1 |
| Elektron | e- | -1 | buiten de kern | 0.0005 (~0) |
Voorbeeld
Wat is waar?
- De atoomkern bevat protonen en elektronen.
- De massa van een elektron is inbegrepen in de massa van het atoom
- Voor een atoom geldt: aantal protonen = aantal elektronen.
Oplossing
- False, de kern bevat de protonen en de neutronen. Elektronen bevinden zich buiten de kern.
- Niet waar, elektronen dragen niet bij aan het massagetal van een atoom.
- Waar, alle atomen zijn neutraal en moeten evenveel protonen als elektronen hebben.




