CHEM 245 – Enzyminhibitie
BIOCHEMISTRY TOPICS
Enzyminhibitie
Soorten remmers en inhibitie.Reversibele en irreversibele remmers en inhibitie. Modellen voor en kinetische effecten van competitieve en niet-competitieve remming. Gemengde remming.Voorbeelden van enzymremming.
De specificiteit van enzymen is niet strikt beperkt tot substraten. Vaak wordt de activiteit van een enzym verminderd door specifieke interacties met moleculen die remmers worden genoemd. Enzymremming is een van de belangrijkste verschijnselen in de biochemie. Zo oefenen vele geneesmiddelen, antibiotica en toxines hun werking uit door hun vermogen een enzym te remmen. Inhibitoren die structureel vergelijkbaar zijn met het substraat zijn vaak competitieve inhibitoren, aangezien zij concurreren voor binding aan de actieve site. Enzymremming kan reversibel zijn (zoals gewoonlijk het geval is wanneer een remmer zich via niet-covalente interacties aan het enzym bindt) of irreversibel (zoals in talrijke gevallen voorkomt wanneer remmers via covalente modificaties aan het enzym werken, misschien gericht op een kritisch residu voor de katalyse).
We kunnen ons verschillende eenvoudige modellen voor reversibele remming voorstellen. Het eenvoudigste is de directe occlusie van de actieve site door de remmer. Dit zou het geval zijn bij een molecule met enige structurele gelijkenis met het substraat. Binding van substraat en remmer zijn wederzijds exclusief in dit model voor competitieve remming.
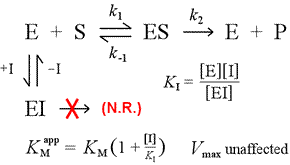
Rechts is een eenvoudig mechanistisch model voor competitieve remming weergegeven. De remmer, I, bindt alleen aan het vrije enzym E, met een dissociatieconstante KI , en blokkeert de binding van het substraat (S). Door een deel van het enzym vast te binden in het inactieve EI-complex, is er bij een gegeven substraatconcentratie minder van het enzym beschikbaar om zich met het substraat te verbinden en ES te vormen en vervolgens eventueel om te zetten in producten. Er is dan meer nodig om ½Vmax te bereiken, zodat de schijnbare waarde van KM toeneemt.
Door de toename tot steeds grotere niveaus kan het substraat de remmer overweldigen, waardoor het vrije enzym wordt overstemd door de remmer, zodat de werkelijke Vmax nog kan worden benaderd.
We kunnen ons gemakkelijk voorstellen dat een molecuul dat in bepaalde belangrijke structurele kenmerken op het substraat lijkt, met het substraat kan concurreren voor binding aan de actieve site. Dit wordt een substraatanaloog genoemd, en het zijn veel voorkomende voorbeelden van competitieve remmers van enzymen. Als enzymen de reactiesnelheid verhogen door selectief de overgangstoestand van de reactie te stabiliseren, dan zou, als we een molecuul kunnen vinden dat lijkt op de overgangstoestand (qua structuur en polariteit of lading), zo’n overgangstoestandanalogon een zeer goede competitieve remmer moeten zijn.
We zullen het competitieve remmingsmodel vergelijken met niet-competitieve remming, waarbij de remmer alleen bindt aan het enzym-substraat complex. Men kan zich voorstellen dat dit gebeurt als gevolg van een enzym-substraatinteractie van het geïnduceerde-type, waarbij een bindingsplaats voor een remmer uitsluitend beschikbaar is in de geïnduceerde conformatie van ES.
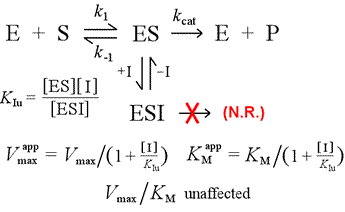
Links: Een mechanistisch model voor niet-competitieve remming. In dit model bindt de remmer alleen het ES-complex, en niet het vrije enzym. Het ternaire complex, ESI, komt niet tot producten. Dit heeft tot gevolg dat de schijnbare Vmax daalt. De dissociatieconstante van de remmer voor ESI wordt KIu genoemd. In een effect dat wordt verklaard door het principe van Le Châtelier, is de schijnbare KM lager, omdat de binding van de remmer een deel van het product (ES) van het ES-vormings “evenwicht” verwijdert.
Een model voor remming waarbij de remmer zowel aan het vrije enzym als aan het enzym-substraatcomplex bindt, is gemengde remming. De dissociatieconstante van de remmer kan verschillen tussen E en ES (d.w.z. KI ≠ KIu). Het speciale geval waarin KI = KIu wordt aangeduid met de term niet-competitieve remming. Merk op dat in dit geval KM niet wordt beïnvloed, terwijl Vmax wordt verlaagd.
Typen omkeerbare remming van enzymen – een samenvatting
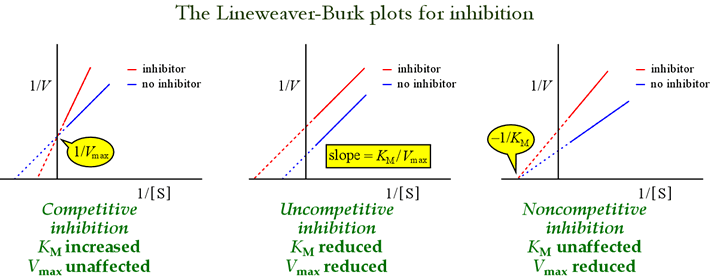
We hebben gezien dat de verschillende modellen voor omkeerbare remming kunnen worden onderscheiden naar de effecten op kinetische parameters. Onderstaande tabel geeft een overzicht van de soorten remming en hun effecten op deze parameters.

De Lineweaver-Burk, of dubbel-reciprocal plots zijn nuttig om remmingspatronen te identificeren. De onderstaande figuur laat zien hoe verschillende soorten remming de plot beïnvloeden.
Voorbeelden van enzymremming
Het eerste en meest gebruikte geneesmiddel, acetylsalicylaat (salicylaat = orthohydroxybenzoaat), algemeen bekend als aspirine, is een effectief analgeticum (pijnstiller), antipyreticum (koortsverlager), en ontstekingsremmend middel. De geneeskrachtige eigenschappen van wilgenbast waren in sommige culturen al eeuwenlang bekend. In de 19e eeuw werd ontdekt dat het actieve bestanddeel een combinatie van en salicylalcohol was. Op basis van deze en andere waarnemingen, alsmede van de vooruitgang op het gebied van de chemische synthese, kwam halverwege de vorige eeuw aspirine op de markt, dat werd bereid door Hoffman, een chemicus in dienst van Bayer. Modernere onderzoeken hebben vastgesteld dat de geneeskrachtige eigenschappen van aspirine grotendeels voortvloeien uit zijn vermogen tot onomkeerbare remming van een enzym dat bekend staat als cyclo-oxygenase en dat nodig is voor de synthese van prostaglandinen en thromboxanen.
Cyclo-oxygenasen katalyseren de eerste stap in de omzetting van arachidonaat in een precursor van prostaglandinen en thromboxanen, prostaglandine G2 (PGG2, structuren en reactie). De reactie gebruikt twee moleculen O2 en zet het C20:4 vetzuur om in een geperoxideerde molecule die een cyclopentaanring bevat (PGG2 – PG staat voor “prostaglandine”). Het cyclooxygenase-enzym bezit ook een hydroperoxidase-activiteit die PGG2 omzet in PGH2. Cyclooxygenase” (COX) kan dus beter worden aangeduid als prostaglandine endoperoxide H synthase (PGHS). De remming van de cyclo-oxygenase-activiteit door aspirine is toe te schrijven aan het vermogen van aspirine om een serineresidu (Ser530) van het enzym chemisch te wijzigen. Het serineresidu krijgt van aspirine een acetylgroep, een onomkeerbare modificatie. Aspirine is dus een voorbeeld van een irreversibele remmer. Er zijn eigenlijk twee COX-isozymes: een constitutieve vorm, COX-1 (PGHS-1), en een geïnduceerde vorm (onder ontstekingsomstandigheden), COX-2 (PGHS-2). Niet-steroïde ontstekingsremmende geneesmiddelen (NSAID’s), zoals aspirine, ibuprofen en naproxen, remmen in het algemeen beide isovormen. Bijgevolg veroorzaken deze geneesmiddelen ongewenste bijwerkingen, bv. gastro-intestinale irritatie. Een van de huidige doelstellingen van het farmacologisch onderzoek is dan ook de ontwikkeling van remmers die specifiek werken op COX-2, een effect waarvan wordt aangenomen dat het het grootste deel van de pijnstillende en ontstekingsremmende effecten van NSAID’s bewerkstelligt.
Gerelateerde onderwerpen pagina’s:
- inleidende chemische kinetiek
- inleidende enzymologie
- enzymkinetiek
- Michaelis-Menten-vergelijking




