CHEM 245 – Inhibice enzymů
BIOCHEMIE TÉMATA
Inhibice enzymů
Druhy inhibitorů a inhibice. reverzibilní a ireverzibilní inhibitory a inhibice. Modely a kinetické účinky kompetitivní a nekompetitivní inhibice. Smíšená inhibice. příklady inhibice enzymů.
Specifičnost enzymů není striktně omezena na substráty. Často je aktivita enzymu snížena specifickými interakcemi s molekulami označovanými jako inhibitory. Inhibice enzymů je jedním z nejdůležitějších jevů v biochemii. Například mnoho léčiv, antibiotik a toxinů uplatňuje své účinky díky své schopnosti inhibovat enzym. Inhibitory, které jsou strukturně podobné substrátu, jsou často kompetitivními inhibitory, protože soutěží o vazbu v aktivním místě. Inhibice enzymu může být reverzibilní (jak je tomu obvykle v případě, kdy se inhibitor váže na enzym prostřednictvím nekovalentních interakcí) nebo ireverzibilní (jak k tomu dochází v mnoha případech, kdy inhibitory působí prostřednictvím kovalentních modifikací enzymu, třeba cíleně na kritický zbytek pro katalýzu).
Můžeme si představit několik jednoduchých modelů reverzibilní inhibice. Nejjednodušší z nich je přímá okluze aktivního místa inhibitorem. To bychom viděli v případě molekuly s určitou strukturní podobností se substrátem. Vazba substrátu a inhibitoru se v tomto modelu kompetitivní inhibice vzájemně vylučuje.
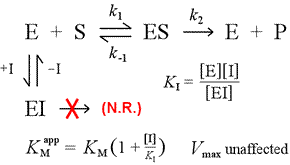
Vpravo je zobrazen jednoduchý mechanistický model pro kompetitivní inhibici. Inhibitor I se váže pouze na volný enzym E s disociační konstantou KI a blokuje vazbu substrátu (S). Tím, že je část enzymu vázána v neaktivním komplexu EI, je ho při dané koncentraci substrátu k dispozici méně, aby se spojil se substrátem a vytvořil ES a poté se případně přeměnil na produkty. Dojde ke zvýšení množství potřebného k dosažení ½Vmax, a proto se zvýší zdánlivá hodnota KM.
Zvýšením na stále vyšší úroveň může substrát zahltit inhibitor a překonat ho pro volný enzym do té míry, že se lze ještě přiblížit skutečné Vmax.
Lze si snadno představit, že molekula, která se podobá substrátu v určitých klíčových strukturních rysech, by mohla se substrátem soutěžit o vazbu v aktivním místě. To se nazývá substrátový analog a představují běžné příklady kompetitivních inhibitorů enzymů. Pokud enzymy zvyšují rychlost reakce tím, že selektivně stabilizují přechodný stav reakce, pak pokud můžeme najít molekulu, která se podobá přechodnému stavu (strukturou a polaritou nebo nábojem), měl by být takový analog přechodného stavu velmi dobrým kompetitivním inhibitorem.
Model kompetitivní inhibice postavíme do kontrastu s nekompetitivní inhibicí, při níž se inhibitor váže pouze na komplex enzym-substrát. Lze si představit, že k tomu dochází v důsledku interakce enzym-substrát typu indukovaný fit, při níž je vazebné místo pro inhibitor k dispozici výhradně v indukované konformaci ES.
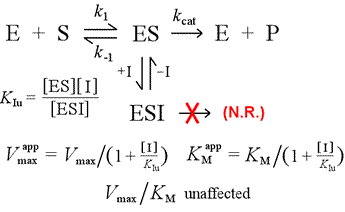
Vlevo: Mechanistický model nekompetitivní inhibice. V tomto modelu se inhibitor váže pouze na komplex ES, nikoli na volný enzym. Ternární komplex, ESI, nepřechází na produkty. To má za následek snížení zdánlivé Vmax. Disociační konstanta inhibitoru pro ESI se označuje KIu. V důsledku vysvětleném Le Châtelierovým principem je zdánlivá KM nižší, protože vazba inhibitoru odstraňuje část produktu (ES) z „rovnováhy“ tvorby ES.
Model inhibice, při kterém inhibitor váže jak volný enzym, tak komplex enzym-substrát, je smíšená inhibice. Disociační konstanta inhibitoru se může lišit mezi E a ES (tj. KI ≠ KIu). Zvláštní případ, kdy KI = KIu, se označuje jako nekompetitivní inhibice. Všimněte si, že v tomto případě není KM ovlivněna, zatímco Vmax je snížena.
Typy reverzibilní inhibice enzymů – shrnutí
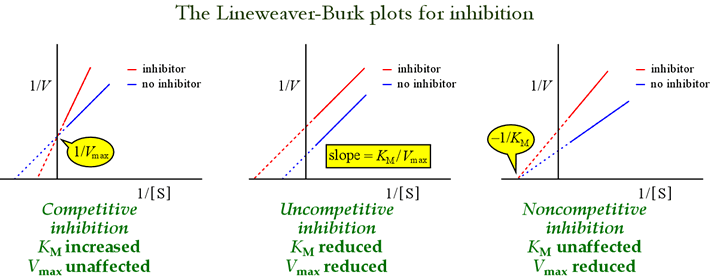
Viděli jsme, že různé modely reverzibilní inhibice lze rozlišit podle vlivu na kinetické parametry. Následující tabulka shrnuje typy inhibice a jejich účinky na tyto parametry.

Pro identifikaci modelů inhibice jsou užitečné Lineweaverovy-Burkovy nebo dvojité reciproké grafy. Následující obrázek ukazuje, jak různé typy inhibice ovlivňují graf.
Příklady inhibice enzymů
První a nejpoužívanější lék, acetylsalicylát (salicylát = orthohydroxybenzoát), obecně známý jako aspirin, je účinné analgetikum (lék proti bolesti), antipyretikum (lék snižující horečku) a protizánětlivý prostředek. Léčivé vlastnosti vrbové kůry byly v některých kulturách známy již po staletí. V 19. století bylo zjištěno, že účinnou látkou je kombinace salicylu a alkoholu. Na základě těchto a dalších pozorování a pokroku v chemické syntéze byl v polovině století k dispozici aspirin, který připravil chemik Hoffman, zaměstnanec firmy Bayer. Modernější výzkumy prokázaly, že léčivé vlastnosti aspirinu pocházejí z velké části z jeho schopnosti ireverzibilně inhibovat enzym známý jako cyklooxygenáza, který je nezbytný pro syntézu prostaglandinůa tromboxanů.
Cyklooxygenázy katalyzují první krok přeměny arachidonátu na prekurzor prostaglandinů a tromboxanů, prostaglandin G2 (PGG2, struktury a reakce). Reakce využívá dvě molekuly O2 a přeměňuje mastnou kyselinu C20:4 na peroxidovanou molekulu obsahující cyklopentanový kruh (PGG2 – PG znamená „prostaglandin“). Enzym cyklooxygenáza má také hydroperoxidázovou aktivitu, která přeměňuje PGG2 na PGH2. Proto by se „cyklooxygenáza“ (COX) měla přesněji označovat jako prostaglandin endoperoxid H syntáza (PGHS). Inhibice aktivity cyklooxygenázy aspirinem je způsobena jeho schopností chemicky modifikovat serinový zbytek (Ser530) enzymu. Tento serinový zbytek získává od aspirinu acetylovou skupinu, což je ireverzibilní modifikace. Aspirin je tedy příkladem ireverzibilního inhibitoru. Ve skutečnosti existují dva izozymy COX: konstitutivní forma COX-1 (PGHS-1) a indukovaná forma (za podmínek zánětu) COX-2 (PGHS-2). Nesteroidní protizánětlivé léky (NSAID), jako je aspirin, ibuprofen a naproxen, obecně inhibují obě izoformy. V důsledku toho tyto léky vyvolávají nežádoucí vedlejší účinky, např. podráždění zažívacího traktu. Současným cílem farmakologického výzkumu je proto vývoj inhibitorů specifických pro COX-2, o němž se předpokládá, že zprostředkovává většinu analgetických a protizánětlivých účinků NSAID.
Související stránky s tématy:
Související stránky s tématy:
- úvodní chemická kinetika
- úvodní enzymologie
- enzymová kinetika
- Michaelisova-Mentenova rovnice
.




