Chlorid sodný, NaCl
Klasický případ iontové vazby, molekula chloridu sodného vzniká ionizací atomů sodíku a chloru a přitahováním vzniklých iontů.
Atom sodíku má jeden elektron 3s mimo uzavřený obal a k odebrání tohoto elektronu je zapotřebí pouze 5,14 elektronvoltu energie. Chloru chybí jeden elektron k zaplnění slupky a při získání tohoto elektronu uvolní 3,62 eV (jeho elektronová afinita je 3,62 eV) To znamená, že k odevzdání jednoho z elektronů sodíku chloru je zapotřebí pouze 1,52 eV energie, když jsou od sebe daleko. Když se výsledné ionty přiblíží k sobě, jejich elektrická potenciální energie je stále zápornější a dosahuje -1,52 eV při vzdálenosti přibližně 0,94 nm. To znamená, že pokud by se neutrální atomy sodíku a chloru ocitly blíže než 0,94 nm, bylo by energeticky výhodné přenést elektron z Na na Cl a vytvořit iontovou vazbu.
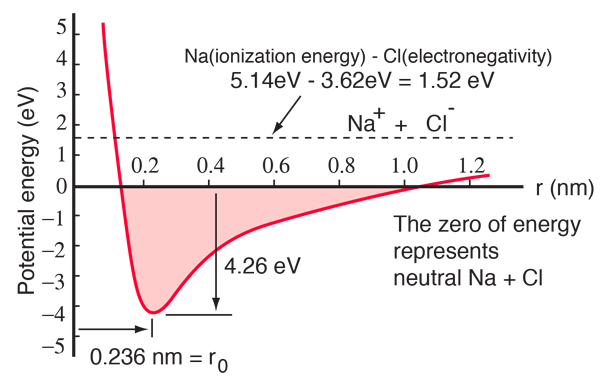
Křivka potenciální energie ukazuje, že při vzdálenosti 0,236 nm je minimum a pak následuje strmý nárůst potenciálu, který představuje odpudivou sílu. Tato odpudivá síla je více než jen elektrostatické odpuzování mezi elektronovými mračny obou atomů. Má kvantově mechanický charakter, který má kořeny v Pauliho vylučovacím principu, a často se nazývá právě „odpuzování vylučovacím principem“. Jsou-li ionty od sebe značně vzdáleny, vlnové funkce jejich jaderných elektronů se výrazně nepřekrývají a mohou mít shodná kvantová čísla. Jak se přibližují, rostoucí překrývání vlnových funkcí způsobuje, že některé z nich jsou nuceny přejít do vyšších energetických stavů. Žádné dva elektrony nemohou zaujímat stejný stav, takže jak se vytváří nový soubor energetických stavů složeného systému se dvěma jádry, nižší energetické stavy se zaplňují a některé elektrony jsou vytlačovány do vyšších stavů. To vyžaduje energii a projevuje se jako odpuzování, které brání tomu, aby se ionty k sobě přiblížily.
Výše uvedený potenciální diagram je pro plynný NaCl, v normálním pevném stavu, kde chlorid sodný (běžná kuchyňská sůl) tvoří krychlové krystaly, je prostředí jiné. Rozdělení iontů je 0,28 nm, tedy o něco větší než v plynném stavu.
Důležitou součástí studia struktury molekul je popis chemických vazeb, které vznikají mezi atomy. Klasickým studiem jsou extrémy iontové vazby v chloridu sodném a kovalentní vazby v molekule vodíku.
| Chemické vazby | Pauliho odpuzování v iontových vazbách |
Příklad energie vazby




