CHEM 101 – Elektrolytter
GENERAL CHEMITRY TOPICS
Elektrolytter
Dissociation af ionforbindelser i vand resulterer i dannelsen af mobile vandige ioniske arter.Kemiske ligninger for opløsning og dissociation i vand. Stærke og svage elektrolytter.
Elektrolytter (musikalsk akkompagnement til dette emne) er stoffer, der danner ioniske arter i vandig opløsning. Eksistensen af ladningsbærere i opløsning kan påvises ved hjælp af et simpelt forsøg. Ledningsevnen i vandige medier kan observeres ved hjælp af et par elektroder, der er forbundet til en spændingskilde, og som er nedsænket i opløsningen. Den strøm, som opløsningen så leder, kan let måles, og en glødepære kan bruges som en visuel indikator for opløsningens ledningsevne.
Når dette forsøg udføres med rent vand, lyser pæren slet ikke. Vand i sig selv leder ikke let elektricitet; det er et eksempel på et molekylært stof, der er en ikke-elektrolyt. Dette gælder også for mange andre molekylære stoffer. F.eks. er bordsukker (saccharose, C12H22O11) – ganske opløseligt i vand, men en sukkeropløsning leder tilsyneladende ikke elektricitet bedre end vand alene. Når vi derimod udfører forsøget med en frit opløselig ionisk forbindelse som natriumchlorid, lyser pæren kraftigt.
Lad os repræsentere, hvad vi tror, der foregår i disse kontrasterende tilfælde af opløsning af en molekylær og en ionisk forbindelse ved at skrive følgende kemiske ligninger:
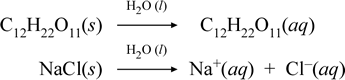
Den første ligning ovenfor repræsenterer opløsningen af en ikke-elektrolyt, nemlig den molekylære forbindelse saccharose. Den anden ligning repræsenterer opløsningen af en ionisk forbindelse, natriumchlorid.Den vigtigste forskel mellem de to kemiske ligninger i dette tilfælde er, at der i sidstnævnte dannes vandige ioniske arter som produkter. Ionerne kan frit diffundere individuelt i en homogen blanding, og når der påføres en spænding, vil ionerne bevæge sig i overensstemmelse med den elektriske potentialeenergidifference mellem elektroderne, hvorved de transporterer elektrisk strøm. Bemærk, at vand ikke er vist på reaktantsiden af disse ligninger, men i stedet er vist over pilen, hvilket angiver, at vand bestemmer det miljø, hvori opløsningsprocessen finder sted. Vandets superstoiometriske status i denne symbolik kan læses som en opløsningsproces, der finder sted med vand som opløsningsmiddel. Vi vil ikke skrive vand som en reaktant i dannelsen af en vandig opløsning ved en simpel opløsningsproces. Der er mange tilfælde, hvor et stof reagerer med vand, når det blandes med og opløses i vand. Denne reaktion af en opløst stof i vandig opløsning giver anledning til kemisk forskellige produkter. I sådanne tilfælde kan vand eksplicit vises i den kemiske ligning som en reaktantart.
Stærke og svage elektrolytter
Det viser sig, at når en opløselig ionisk forbindelse som f.eks. natriumchlorid undergår opløsning i vand for at danne en vandig opløsning bestående af solvente ioner, er den pil til højre, der anvendes i den kemiske ligning, berettiget, idet (så længe opløselighedsgrænsen ikke er nået) det faste natriumchlorid, der tilsættes til opløsningsvandet, fuldstændigt dissocieres. Med andre ord sker der faktisk en 100 % omdannelse af NaCl(s) til Na+(aq) og Cl-(aq). Som følge heraf er en natriumchloridopløsning i vores ledningsevneforsøg meget ledende på grund af den store mængde ioner, og pæren lyser stærkt. I et sådant tilfælde siger vi, at natriumklorid er en stærk elektrolyt.
I modsætning hertil kan man betragte det molekylære stof eddikesyre, HC2H3O2.Når eddikesyre opløses i vand, danner den en udisocieret, solvent molekylær art, symboliseret som HC2H3O2(aq), i lighed med tilfældet med saccharose ovenfor. Men når vi udfører vores ledningsevneprøve med en eddikesyreopløsning, finder vi, at pæren lyser, om end ret svagt sammenlignet med den lysstyrke, der er observeret for natriumchloridopløsningen. I dette tilfælde må der i det mindste delvis dannes ioner fra eddikesyre i vand. En kemisk ligning, der repræsenterer denne proces, skal vise, at der dannes ioner. Et rimeligt forslag til en sådan ligning ville være:
![]()
To ting er vigtige at bemærke her. For det første er der her tale om et tilfælde, hvor vi medtager vand som reaktant. De to molekylære stoffer, vand og eddikesyre, reagerer under dannelse af de polyatomare ioner hydronium og acetat. Den ligning, der repræsenterer dette, er en ionisk ligning. Det andet træk, der fortjener en nærmere diskussion, er udskiftningen af pilen til højre med symbolet med dobbelte pile med en enkelt bjælke, der angiver en kemisk ligevægt, og i dette tilfælde er ligevægtsbetingelsen for reaktionen til fordel for reaktanterne, hvilket betyder, at i en vandig opløsning af eddikesyre forbliver det meste af eddikesyren som eddikesyremolekyler, idet kun en lille del på ethvert tidspunkt har afgivet H+ til vand for at danne ionerne. Det lille antal ioner, der dannes, forklarer, hvorfor eddikesyreopløsningen ikke leder elektricitet lige så godt som natriumchloridopløsningen, hvilket kun resulterer i en svag belysning af pæren i vores ledningsevne-detektor. Vi skelner derfor mellem stærke elektrolytter, såsom natriumklorid, og eddikesyre, som er et eksempel på en svag elektrolyt.
Som navnet eddikesyre antyder, er dette stof også en syre og samtidig en svag elektrolyt. Derfor klassificerer vi eddikesyre som en svag syre. Vores første (og mindst generelle) definition af en syre er et stof, der danner hydroniumioner i vand, hvilket netop er, hvad vores ioniske ligning ovenfor viser, idet vi skal huske på, at en svag syre danner relativt små mængder hydroniumioner.
Kemikere er meget glade for forkortelser, og en vigtig forkortelse for hydroniumion er H+(aq), og dette er almindeligt anvendt. Dette er vist i den forkortede version af ovenstående ligning, som er vist lige nedenfor. For at gøre det klart, at H+ i sig selv blot ville være en isoleret proton (for 1H); det er derfor også vigtigt at bemærke, at der ikke findes en sådan art i vandig opløsning.
Dertil kommer, at pilene er lavet af ulige længde for at angive den reaktantbegunstigede ligevægt, hvor der er langt færre ioner end eddikesyremolekyler.
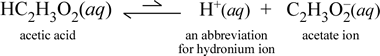
Gennem at repræsentere hydronium som H+(aq) er den ioniske ligning for eddikesyre i vand formelt set balanceret uden at inkludere et vandmolekyle som reaktant, hvilket er implicit i ovenstående ligning.
Ammoniak: Et eksempel på en svag elektrolyt, der er en svag base
Acetinsyre er, som vi netop har set, en molekylær forbindelse, der er en svag syre og elektrolyt. Ammoniak, NH3, en anden simpel molekylforbindelse, reagerer også i et lille omfang med vand og danner ammonium- og hydroxidioner. Vores første, mindst generelle definition af en base er et stof, der danner hydroxidioner i vand. Ammoniak er således en svag base, og ligesom eddikesyre leder den ikke elektricitet nær så godt som vandigt salt. Derfor er ammoniak også en svag elektrolyt.
![]()
Symbolikken i vores kemiske ligning viser igen en reaktantbegunstiget ligevægt for den svage elektrolyt.
Udvidelser og sammenhænge
En mere kvantitativ tilgang til ligevægte bruger svage syrer og svage basersom vigtige eksempler.




