Enzymhæmning
Enzymer er nødvendige for de fleste, hvis ikke alle, af de processer, der er nødvendige for livet. Enzymer katalyserer en reaktion ved at reducere den aktiveringsenergi, der er nødvendig for, at reaktionen kan finde sted. Enzymer skal imidlertid reguleres nøje for at sikre, at niveauet af produktet ikke stiger til et uønsket niveau. Dette opnås ved hjælp af enzymhæmning.
Typer af hæmning
Reversible og irreversible hæmmere er kemikalier, som binder sig til et enzym for at undertrykke dets aktivitet. En metode til at opnå dette er at binde sig næsten permanent til et enzym. Disse typer af inhibitorer kaldes irreversible. Andre kemikalier kan imidlertid binde sig forbigående til et enzym. Disse kaldes reversible. Reversible hæmmere binder enten til et aktivt sted (kompetitive hæmmere) eller til et andet sted på enzymet (ikke-kompetitive hæmmere).
 Fig 1 – Diagram til visning af virkningen af kompetitive og ikke-kompetitive enzymhæmmere.
Fig 1 – Diagram til visning af virkningen af kompetitive og ikke-kompetitive enzymhæmmere.Kompetitive hæmmere
Kompetitive hæmmere konkurrerer med substratet på det aktive sted og øger derfor Km (Michaelis-Menten-konstanten). Vmax er dog uændret, fordi reaktionen med tilstrækkelig substratkoncentration stadig kan fuldføres med tilstrækkelig substratkoncentration. Grafplottet for enzymaktivitet mod substratkoncentrationen vil være forskudt mod højre på grund af stigningen i Km, mens Lineweaver-Burke-plottet vil være stejlere sammenlignet med ingen inhibitor.
Non-kompetitive inhibitorer
Non-kompetitive inhibitorer binder sig til et andet sted på enzymet og nedsætter dermed VMAX. KM er dog uændret. Dette påvises ved et lavere maksimum på en graf, der viser enzymaktiviteten i forhold til substratkoncentrationen, og et højere y-intercept på et Lineweaver-Burke-plot sammenlignet med ingen inhibitor.
| Kompetitiv | Non-kompetitiv | |
| Hvor virker den? | Aktivt sted | Alternativt sted |
| Ændring af Km | Stigning | Uændret |
| Ændring af Vmax | Uændret | Sænkning |
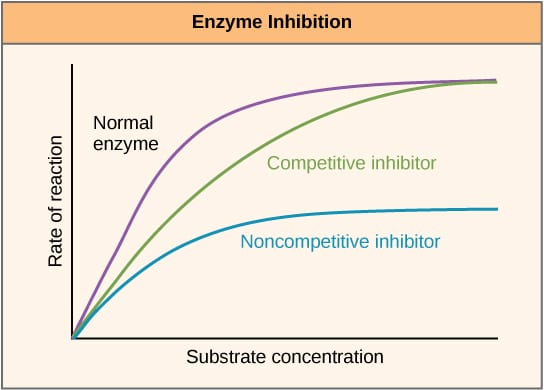 Fig 2 – Diagram, der viser virkningen af enzymhæmmere på reaktionshastigheden, og hvordan den varierer med substratkoncentrationen.
Fig 2 – Diagram, der viser virkningen af enzymhæmmere på reaktionshastigheden, og hvordan den varierer med substratkoncentrationen.Allosterisk hæmning
Allosteriske enzymer viser en sigmoidkurve i modsætning til den hyperboliske kurve, der vises af Michaelis-Menten-enzymer. Dette skyldes, at de fleste allosteriske enzymer indeholder flere underenheder, som kan påvirke hinanden, når substratet binder til enzymet. Hæmning kan påvirke enten K0,5, som er substratkoncentrationen for halvsaturering, Vmax eller begge dele. Dette resulterer i en forskydning af kurven til højre, og i tilfælde af reduktion af Vmax forskydes kurven nedad.
Allosteriske enzymer har to tilstande: en tilstand med lav affinitet, der kaldes “T”-tilstanden, og en tilstand med høj affinitet, “R”-tilstanden. Inhibitorer virker ved fortrinsvis at binde sig til T-tilstanden i et allosterisk enzym, hvilket får enzymet til at opretholde denne tilstand med lav affinitet.
Dette er yderst nyttigt til at begrænse mængden af et enzymprodukt, da produktet derefter kan fortsætte med at hæmme den samme type enzym for at sikre, at mængden af produkt ikke er for stor. Dette er kendt som feedback-inhibering. F.eks. hæmmer ATP allosterisk pyruvatkinase for at forhindre øget dannelse af pyruvat, så der i sidste ende dannes mindre ATP. Desuden er phosphofructokinase allosterisk hæmmet af citrat, et mellemprodukt i Kreb’s cyklus. Dette betyder, at glykolysen vil blive begrænset, når der er høj ATP-generering fra Kreb’s cyklus.
 Fig 3 – Diagram til visning af mekanismen for både allosterisk hæmning og aktivering.
Fig 3 – Diagram til visning af mekanismen for både allosterisk hæmning og aktivering.Fosforylering
Fosforylering giver en anden mekanisme, hvormed enzymer kan hæmmes. Dette sker typisk gennem virkningen af kinaseenzymer, som enten kan hæmme eller aktivere et enzym afhængigt af situationen. Kinaseenzymerne spalter en fosfatgruppe fra ATP og binder den til enzymet. I situationer, hvor dette resulterer i en stigning i enzymaktiviteten, skaber det en kaskadereaktion, hvilket gør det muligt at generere et stort respons ud fra en lille stimulus.
Zymogener
Enzymer kan også udskilles i inaktiv tilstand, som kaldes zymogener. Zymogener er en nyttig mekanisme, som gør det muligt at transportere enzymer sikkert til forskellige steder, uden at enzymet bliver aktivt og udfører sin funktion undervejs. De forbliver inaktive på grund af en tilsætning af aminosyrer i proteinet. For at aktivere et zymogen skal et andet enzym derfor spalte disse ekstra aminosyrer af for at aktivere det. F.eks. syntetiseres chymotrypsinogen af bugspytkirtlen, men det er inaktiveret og kan ikke fungere. Når det når frem til tarmene, spalter et andet enzym (trypsin) de ekstra aminosyrer for at fremstille den aktiverede form, chymotripsin.
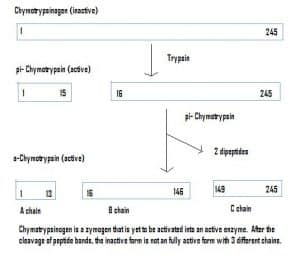 Fig. 4 – Diagram, der viser aktiveringen af chymotrypsinogen i mave-tarmsystemet og de enzymer, der er involveret på hvert trin.
Fig. 4 – Diagram, der viser aktiveringen af chymotrypsinogen i mave-tarmsystemet og de enzymer, der er involveret på hvert trin.Klinisk relevans – Farmakokinetik
Den vigtigste kliniske anvendelse af enzymhæmning er brugen af farmaceutiske lægemidler. ACE-hæmmere er en almindelig behandling af hypertension. Angiotensin I omdannes til Angiotensin II ved hjælp af Angiotensin Converting Enzyme (ACE). Angiotensin II forårsager imidlertid en lang række virkninger, der har at gøre med en stigning i blodtrykket. Derfor blev ACE-hæmmere udviklet til at hæmme ACE’s virkning på konkurrerende vis, hvilket resulterer i mindre dannelse af Angiotensin II og lavere blodtryk.
Alternativt binder penicillin irreversibelt til det aktive sted i et enzym, der kaldes DD-transpeptidase. DD-transpeptidase er ansvarlig for det sidste trin i bakteriernes cellevægssyntese. Ved at hæmme dette enzym kan bakterierne ikke syntetisere en cellevæg og kan derfor ikke opretholde livet.
Endelig er cyanid et eksempel på en ikke-kompetitiv inhibitor. Cyanid binder sig til det sidste enzym i elektrontransportkæden og forhindrer dette enzym i at katalysere reaktionen fra ilt til vand. Dette forhindrer strømmen af elektroner nedad i elektrontransportkæden, og der kan ikke dannes ATP, hvilket resulterer i døden.




