Fakta om barium
Barium, der er opkaldt efter det græske ord barys for “tungt”, er et relativt tæt og reaktivt alkalisk jordarmetal. Det findes kun naturligt, når det er kombineret med andre grundstoffer, og forbindelser, der indeholder barium, har en lang række anvendelsesmuligheder; de findes i rottegift, vægtningsmidler i olieboringsvæsker og den hvide væske, der bruges til at visualisere tarmene i en røntgendiagnostisk test kaldet et bariumlavement.
Bare fakta
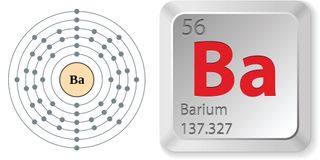
- Atomnummer (antal protoner i kernen): 56
- Atomsymbol (i det periodiske system af grundstoffer): 56
- Atomsymbol (i det periodiske system af grundstoffer): Ba
- Atomvægt (atomets gennemsnitlige masse): 137,327
- Tæthed: 2,09 ounces per kubiktomme (3.62 gram pr. kubikcentimeter)
- Fase ved stuetemperatur: fast stof
- Smeltepunkt: 1.341 grader Fahrenheit (727 grader Celsius)
- Kogningspunkt: 3.447 F (1.897 C)
- Antal naturlige isotoper (atomer af samme grundstof med et forskelligt antal neutroner): 7
- Mest almindelige isotop: 7
- : Ba-138
Opdagelsen af barium
Vincenzo Casciarolo, en italiensk alkymist fra det 17. århundrede, opdagede først barium i form af usædvanlige småsten, der glødede i årevis efter at have været udsat for varme, ifølge Royal Society of Chemistry. Han kaldte disse småsten for “Bologna-sten” efter sin hjemby, men det blev senere fastslået, at de var bariumsulfat (BaSO4). I slutningen af det 18. århundrede blev bariumoxid (BaO) og bariumcarbonat (BaCO3) opdaget af henholdsvis den tyske kemiker Carl Scheele og den engelske kemiker William Withering.
Rent bariummetal blev ikke isoleret og identificeret før 1808 på Royal Institution i London. Den fremtrædende kemiker og opfinder Sir Humphry Davy brugte elektrolyse til at adskille barium fra smeltede bariumsalte som f.eks. bariumhydroxid (Ba(OH)2). Under elektrolyse ledes en elektrisk strøm gennem det ioniske stof for at adskille ioner fra hinanden. Da bariumsaltene var smeltet, bevægede bariumionerne sig let til beholderen med den negative elektrode, og de andre negative ioner bevægede sig let i den modsatte retning til beholderen med den positive elektrode.
Kilder til barium
Barium findes naturligt kun i kombination med andre grundstoffer på grund af dets høje reaktivitet. Barium findes oftest kombineret med sulfat og karbonat, men kan også danne forbindelser med hydroxid, klorid, nitrat, klorat og andre negative ioner. Omkring 0,05 procent af Jordens skorpe består af barium, hvilket gør det til det 17. hyppigst forekommende grundstof i jordskorpen, ifølge Robert E. Krebs i sin bog “The History and Use of Our Earth’s Chemical Elements”: A Reference Guide” (Greenwood Publishing Group, 2006). Mineforekomster i Det Forenede Kongerige, Italien, Tjekkiet, USA og Tyskland indeholder over 400 millioner tons barium ifølge John Emsley i sin bog “Nature’s Building Blocks: An A-Z Guide to the Elements” (Oxford University Press, 1999).
For at opnå rent elementært barium skal det adskilles fra andre grundstoffer, der findes i naturligt forekommende bariumforbindelser. Barium kan udvindes fra bariumklorid ved hjælp af elektrolyse. Barium kan også udvindes ved at reducere bariumoxid ved hjælp af aluminium eller silicium i et vakuum ved høj temperatur og lavt tryk.
Bariums egenskaber
Rent barium er et blødt, sølvhvidt metal. Det klassificeres som et alkalisk jordmetal og befinder sig i gruppe, eller kolonne, 2 i det periodiske system sammen med beryllium, magnesium, calcium, strontium og radium. Hvert af deres atomer indeholder to valenselektroner (de yderste). Barium er i periode, eller række, 5, så det har sine valenselektroner i sin femte skal og kan meget let miste elektronerne eller blive oxideret. Dette forklarer bariums høje reaktivitet, især med elektronegative grundstoffer som ilt.
Kommercielle anvendelser af barium
Elementært barium har ikke mange praktiske anvendelser, igen på grund af dets høje reaktivitet. Men dets stærke tiltrækning til ilt gør det nyttigt som “getter” til at fjerne de sidste spor af luft i vakuumrør. Rent barium kan også kombineres med andre metaller for at danne legeringer, der bruges til at fremstille maskinelementer som f.eks. lejer eller tændrør i forbrændingsmotorer. Fordi barium har et løst greb om sine elektroner, afgiver dets legeringer let elektroner ved opvarmning og forbedrer tændrørets effektivitet, ifølge Krebs.
Forbindelser, der indeholder barium, har en række kommercielle anvendelser. Bariumsulfat, eller baryt, anvendes i lithopon (et lysningspigment i printerpapir og maling), væsker til olieboringer, glasfremstilling og fremstilling af gummi. Bariumcarbonat bruges som rottegift, og bariumnitrat og bariumchlorat giver grønne farver i fyrværkeri.
Barium i kroppen
Den gennemsnitlige voksne indeholder ca. 22 mg barium, fordi det findes i fødevarer som gulerødder, løg, salat, salat, bønner og kornkorn. Bariumniveauet i dine tænder kan faktisk hjælpe forskerne med at afgøre, hvornår babyer overgår fra amning til at spise fast føde. Disse lave niveauer af barium har ingen biologisk funktion og er ikke skadelige.
Men store mængder af opløselige bariumsalte kan være giftige og endog dødelige ifølge John Emsley i sin bog “The Elements of Murder”: A History of Poison” (Oxford University Press, 2005). Barium kan forårsage opkastninger, kolik, diarré, rystelser og lammelser. Der har været en håndfuld mord med bariumforbindelser, herunder et mord i 1994 på en mand i Mansfield, Texas, begået af hans 16-årige datter, Marie Robards, som stjal bariumacetat fra sit kemilaboratorium i gymnasiet. Flere patienter blev også ved et uheld dræbt af barium, da der ved en fejl blev anvendt opløseligt bariumcarbonat i stedet for uopløseligt bariumsulfat under en gastroenterologisk (GI) diagnostisk test kaldet et bariumlavement.
Læger udfører barium lavementer for at visualisere og diagnosticere abnormiteter i tyktarmen og endetarmen, ifølge Johns Hopkins Medicine. Under proceduren indsprøjtes bariumsulfat via endetarmen for at belægge tyktarmens indervægge. Derefter gives der typisk luft for at sikre, at bariumbelægningen fylder alle overfladiske abnormiteter. Derefter anvendes der røntgenstråler til at tage et billede af den nedre del af mave-tarmkanalen. Bariumsulfat absorberer røntgenstråler og fremstår hvidt på røntgenfilmen i modsætning til luften og det omgivende væv, som fremstår sort. Ved at analysere røntgenbilledet fra bariumklædet kan lægerne diagnosticere sygdomme som f.eks. colitis ulcerosa, Crohns sygdom, polypper, kræft og irritabel tyktarm.




