3.3: Subatomare Teilchen – Elektronen, Protonen und Neutronen
Identifizierung und Lokalisierung der subatomaren Teilchen
Im Jahr 1897 bewies der britische Physiker J. J. Thomson (1856-1940), dass Atome nicht die grundlegendste Form der Materie sind. Bei seinen Experimenten verwendete er Kathodenstrahlröhren (CRT). In einer vakuumierten Umgebung erzeugen diese Geräte unsichtbare Strahlen, die von einer negativen Elektrode (Kathode) ausgehen und zu einer positiven Elektrode (Anode) weitergeleitet werden. In diesen Experimenten wies Thomson nach, dass Kathodenstrahlen durch magnetische oder elektrische Felder abgelenkt oder gebogen werden können, was darauf hindeutet, dass Kathodenstrahlen aus geladenen Teilchen bestehen. Noch wichtiger ist, dass Thomson durch die Messung des Ausmaßes der Ablenkung der Kathodenstrahlen in magnetischen oder elektrischen Feldern unterschiedlicher Stärke das Masse-Ladungs-Verhältnis der Teilchen berechnen konnte. Da sich gleiche Ladungen abstoßen und entgegengesetzte Ladungen anziehen, kam Thomson zu dem Schluss, dass die Teilchen eine negative Nettoladung haben; diese Teilchen werden nun Elektronen genannt. Für die Chemie war Thomsons Erkenntnis am wichtigsten, dass das Masse-Ladungs-Verhältnis von Kathodenstrahlen unabhängig von der Beschaffenheit der Metallelektroden oder des Gases ist, was darauf schließen lässt, dass Elektronen grundlegende Bestandteile aller Atome sind.
In den 1910er Jahren führten Experimente mit Röntgenstrahlen zu dieser nützlichen Schlussfolgerung: Die Größe der positiven Ladung im Kern jedes Atoms eines bestimmten Elements ist gleich groß. Mit anderen Worten, alle Atome desselben Elements haben die gleiche Anzahl von Protonen. Darüber hinaus haben verschiedene Elemente eine unterschiedliche Anzahl von Protonen in ihren Kernen, so dass die Anzahl der Protonen im Kern eines Atoms charakteristisch für ein bestimmtes Element ist. Diese Entdeckung war für unser Verständnis der Atome so wichtig, dass die Anzahl der Protonen im Atomkern als Ordnungszahl bezeichnet wird. Diese Experimente wurden von Ernest Rutherford durchgeführt. Ihm wird das Verdienst zugeschrieben, eine zentrale Stelle des Atoms definiert zu haben, die heute als Atomkern bezeichnet wird.
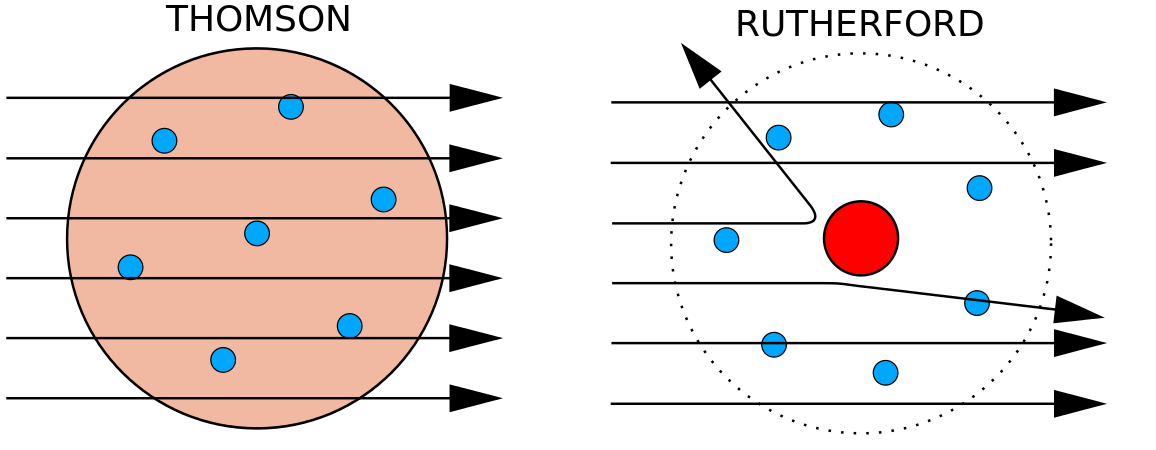
Rutherford war sich bewusst, dass sich die Protonen in diesem Bereich befanden. Einer von Ernest Rutherfords Kollegen, James Chadwick, führte radioaktive Reaktionen von Beryllium durch und studierte sie. Beim Beschuss eines Berylliumkerns mit Alphateilchen wurde ein Neutronenteilchen freigesetzt. Im Jahr 1932 gab James Chadwick die Existenz eines dritten subatomaren Teilchens, des Neutrons, bekannt. Dieses Teilchen hat eine Masse von 1 atomaren Masseneinheit, ist aber ungeladen. Nach dieser Entdeckung begannen Nuklearwissenschaft und -technologie sofort.
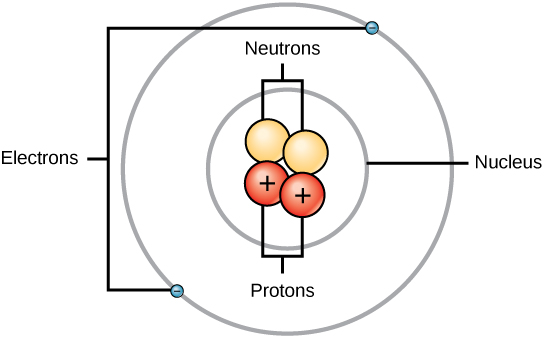
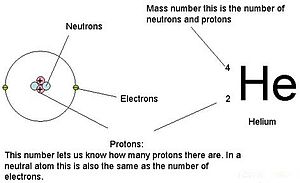
Die Massen der drei subatomaren Teilchen können in amu (atomare Masseneinheiten) oder Gramm angegeben werden. Der Einfachheit halber werden wir die Einheit amu für die drei subatomaren Teilchen verwenden. Sowohl Neutronen als auch Protonen wird eine Masse von je 1 amu zugeordnet. Im Gegensatz dazu hat das Elektron eine vernachlässigbare Masse von 0,0005 amu. Die Masse dieses Subatoms ist in der dezimalen Masse, die im Periodensystem angegeben ist, nicht enthalten. Nur Protonen und Neutronen tragen zum Massenwert eines Atoms bei.
de:User:Materialscientist)
Für Atome (neutrale Spezies) ist die Anzahl der Elektronen gleich der Anzahl der Protonen. Folglich haben alle Atome eine Gesamtladung von Null. Informationen über Ionen (Atome, die Elektronen aufnehmen oder abgeben) finden Sie im letzten Teil dieses Kapitels. Atome, die sich in ihren Neutronen- und Massenwerten von der Tabelle unterscheiden, werden als Isotope bezeichnet. Diese besonderen Arten sind im folgenden Abschnitt des Textes zu sehen.
| Subatomares Teilchen | Symbol | Relative Ladung | Ort | Amu-Masse |
|---|---|---|---|---|
| Proton | p | +1 | innerhalb des Kerns | 1 |
| Neutron | n | 0 | innerhalb des Kerns | 1 |
| Elektron | e- | -1 | außerhalb des Kerns | 0.0005 (~0) |
Beispiel \(\PageIndex{1}\)
Was ist richtig?
- Der Kern enthält Protonen und Elektronen.
- Die Masse eines Elektrons ist in der Masse des Atoms enthalten
- Für ein Atom ist die Anzahl der Protonen = Anzahl der Elektronen.
Lösung
- Falsch, der Kern enthält die Protonen und die Neutronen. Elektronen befinden sich außerhalb des Kerns.
- Falsch, Elektronen tragen nicht zur Massenzahl eines Atoms bei.
- Wahr, alle Atome sind neutral und müssen die gleiche Anzahl von Protonen und Elektronen haben.




