Chemie
Die Bildung einer Lösung ist ein Beispiel für einen spontanen Prozess, einen Prozess, der unter bestimmten Bedingungen abläuft, ohne dass Energie aus einer äußeren Quelle benötigt wird. Manchmal rühren wir ein Gemisch um, um den Auflösungsprozess zu beschleunigen, aber das ist nicht notwendig; eine homogene Lösung würde sich bilden, wenn wir nur lange genug warten würden. Das Thema der Spontaneität ist für das Studium der chemischen Thermodynamik von entscheidender Bedeutung und wird in einem späteren Kapitel dieses Textes ausführlicher behandelt. Für die Zwecke dieses Kapitels reicht es aus, zwei Kriterien zu betrachten, die die spontane Bildung einer Lösung begünstigen, aber nicht garantieren:
- eine Abnahme der inneren Energie des Systems (eine exotherme Änderung, wie im vorangegangenen Kapitel über Thermochemie besprochen)
- eine Zunahme der Unordnung im System (was auf eine Zunahme der Entropie des Systems hindeutet, wie Sie im späteren Kapitel über Thermodynamik erfahren werden)
Beim Auflösungsprozess kommt es häufig, aber nicht immer, zu einer Änderung der inneren Energie, da Wärme absorbiert oder entwickelt wird. Eine Zunahme der Unordnung ist immer die Folge, wenn sich eine Lösung bildet.
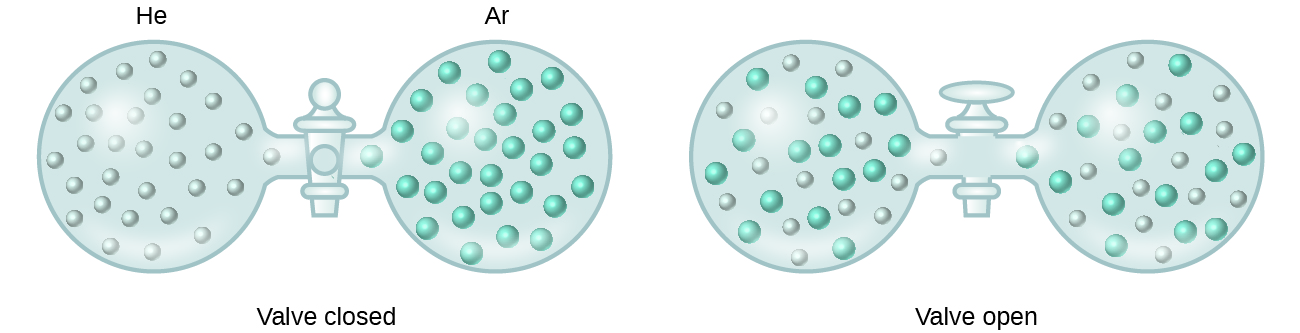
Wenn sich die Stärken der intermolekularen Anziehungskräfte zwischen den gelösten und den lösenden Spezies in einer Lösung nicht von denen unterscheiden, die in den getrennten Komponenten vorhanden sind, bildet sich die Lösung ohne begleitende Energieänderung. Eine solche Lösung wird als ideale Lösung bezeichnet. Ein Gemisch aus idealen Gasen (oder Gasen wie Helium und Argon, die sich dem idealen Verhalten annähern) ist ein Beispiel für eine ideale Lösung, da die Einheiten, aus denen diese Gase bestehen, keine nennenswerten intermolekularen Anziehungen erfahren.
Wenn Behälter mit Helium und Argon verbunden werden, vermischen sich die Gase spontan aufgrund von Diffusion und bilden eine Lösung (Abbildung 2). Die Bildung dieser Lösung geht eindeutig mit einer Zunahme der Unordnung einher, da die Helium- und Argonatome ein Volumen einnehmen, das doppelt so groß ist wie das, das sie vor der Vermischung einnahmen.
Ideale Lösungen können sich auch bilden, wenn strukturell ähnliche Flüssigkeiten gemischt werden. So bilden beispielsweise Mischungen der Alkohole Methanol (CH3OH) und Ethanol (C2H5OH) ideale Lösungen, ebenso wie Mischungen der Kohlenwasserstoffe Pentan, C5H12, und Hexan, C6H14. Wenn man Methanol und Ethanol oder Pentan und Hexan in die in Abbildung 2 gezeigten Glühbirnen gibt, kommt es zur gleichen Diffusion und anschließenden Vermischung dieser Flüssigkeiten wie bei den Gasen He und Ar (wenn auch viel langsamer), was zu Lösungen ohne wesentliche Energieänderung führt. Im Gegensatz zu einem Gasgemisch sind die Komponenten dieser flüssig-flüssigen Lösungen jedoch tatsächlich intermolekularen Anziehungskräften ausgesetzt. Da aber die Moleküle der beiden zu mischenden Stoffe strukturell sehr ähnlich sind, sind die intermolekularen Anziehungskräfte zwischen gleichen und ungleichen Molekülen im Wesentlichen gleich, so dass der Auflösungsprozess keine nennenswerte Energiezunahme oder -abnahme mit sich bringt. Diese Beispiele veranschaulichen, wie die Diffusion allein die treibende Kraft für die spontane Bildung einer Lösung darstellen kann. In einigen Fällen können jedoch die relativen Größen der intermolekularen Anziehungskräfte zwischen gelösten und lösenden Stoffen die Auflösung verhindern.
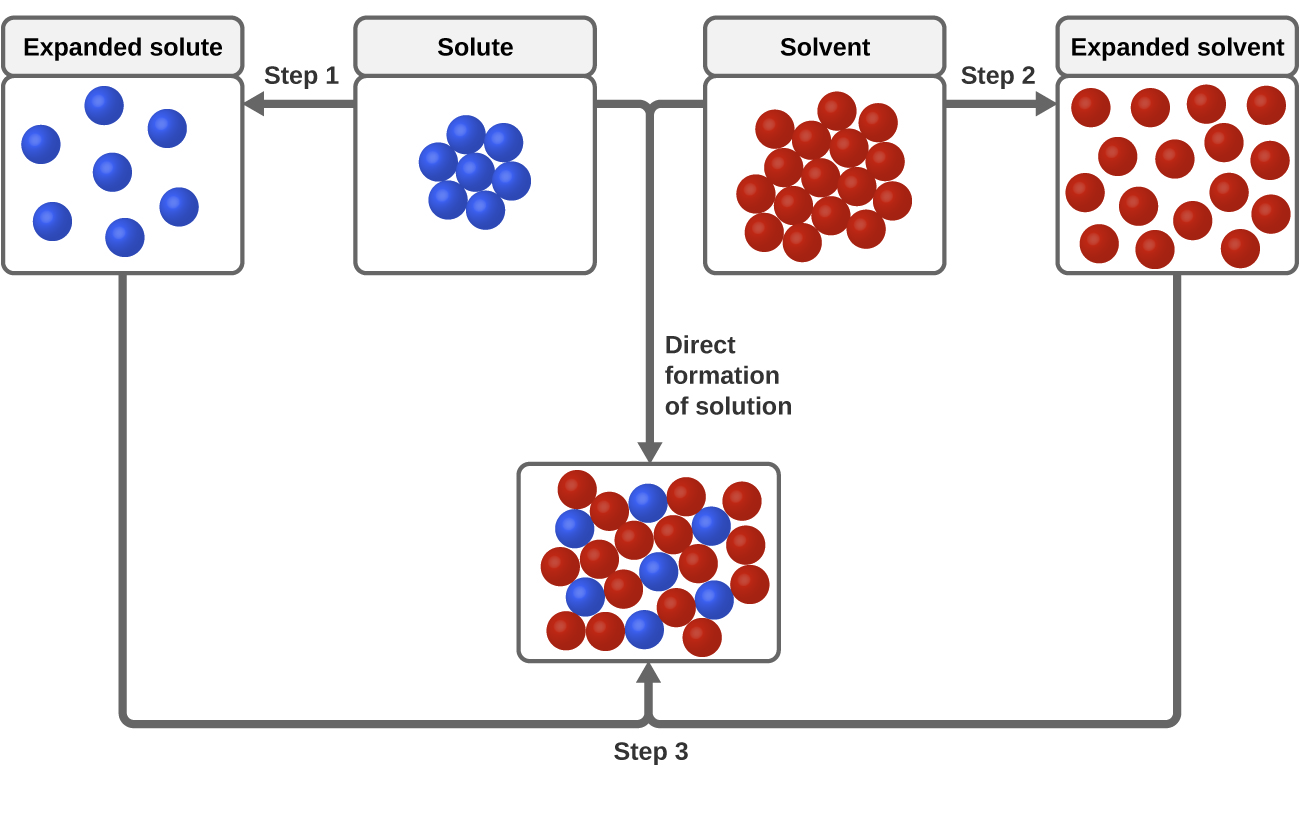
Drei Arten von intermolekularen Anziehungskräften sind für den Lösungsprozess von Bedeutung: gelöster Stoff – gelöster Stoff, Lösungsmittel – Lösungsmittel und Lösungsmittel – Lösungsmittel. Wie in Abbildung 3 dargestellt, kann die Bildung einer Lösung als ein schrittweiser Prozess betrachtet werden, bei dem Energie verbraucht wird, um die Anziehungskräfte zwischen Lösungsmittel und Lösungsmittel zu überwinden (endotherme Prozesse), und bei dem Energie freigesetzt wird, wenn die Anziehungskräfte zwischen Lösungsmittel und Lösungsmittel aufgebaut werden (ein exothermer Prozess, der als Solvatation bezeichnet wird). Die relativen Größenordnungen der mit diesen schrittweisen Prozessen verbundenen Energieänderungen bestimmen, ob der Auflösungsprozess insgesamt Energie freisetzt oder absorbiert. In einigen Fällen bilden sich keine Lösungen, weil die zur Trennung von gelösten und lösenden Spezies erforderliche Energie so viel größer ist als die durch die Solvatation freigesetzte Energie.
Speiseöle und Wasser vermischen sich beispielsweise nicht in nennenswertem Umfang zu Lösungen (Abbildung 4). Die Wasserstoffbrückenbindung ist die vorherrschende intermolekulare Anziehungskraft in flüssigem Wasser; die unpolaren Kohlenwasserstoffmoleküle von Speiseölen sind nicht in der Lage, eine Wasserstoffbrückenbindung einzugehen, sondern werden durch Dispersionskräfte zusammengehalten. Die Bildung einer Öl-Wasser-Lösung würde die Überwindung der sehr starken Wasserstoffbrückenbindungen im Wasser sowie der beträchtlich starken Dispersionskräfte zwischen den relativ großen Ölmolekülen erfordern. Und da die polaren Wassermoleküle und die unpolaren Ölmoleküle keine sehr starke intermolekulare Anziehung erfahren würden, würde durch die Solvatation nur sehr wenig Energie freigesetzt werden.

Ein Gemisch aus Ethanol und Wasser hingegen lässt sich in jedem beliebigen Verhältnis mischen und ergibt eine Lösung. In diesem Fall sind beide Stoffe zu Wasserstoffbrückenbindungen fähig, so dass der Solvatationsprozess ausreichend exotherm ist, um die endothermen Trennungen von gelösten und Lösungsmittelmolekülen zu kompensieren.
Wie zu Beginn dieses Moduls erwähnt, wird die spontane Lösungsbildung durch exotherme Lösungsprozesse begünstigt, aber nicht garantiert. Während sich viele lösliche Verbindungen tatsächlich unter Wärmeabgabe auflösen, lösen sich einige endotherm auf. Ammoniumnitrat (NH4NO3) ist ein solches Beispiel und wird zur Herstellung von Kühlakkus für die Behandlung von Verletzungen verwendet, wie in Abbildung 5 dargestellt. Ein dünnwandiger Plastikbeutel mit Wasser ist in einen größeren Beutel mit festem NH4NO3 eingeschlossen. Wenn der kleinere Beutel aufgerissen wird, bildet sich eine Lösung aus NH4NO3, die Wärme aus der Umgebung (dem verletzten Bereich, auf den das Paket aufgelegt wird) absorbiert und eine kalte Kompresse erzeugt, die die Schwellung verringert. Endotherme Lösungen wie diese erfordern einen größeren Energieaufwand, um die gelösten Spezies zu trennen, als bei der Solvatisierung der gelösten Stoffe zurückgewonnen wird, aber sie sind dennoch spontan aufgrund der Zunahme der Unordnung, die mit der Bildung der Lösung einhergeht.


Schauen Sie sich dieses kurze Video an, das endotherme und exotherme Auflösungsprozesse veranschaulicht.
Schlüsselbegriffe und Zusammenfassung
Eine Lösung bildet sich, wenn sich zwei oder mehr Substanzen physikalisch verbinden, um eine Mischung zu ergeben, die auf molekularer Ebene homogen ist. Das Lösungsmittel ist die am stärksten konzentrierte Komponente und bestimmt den physikalischen Zustand der Lösung. Die gelösten Stoffe sind die anderen Komponenten, die normalerweise in geringeren Konzentrationen als das Lösungsmittel vorliegen. Lösungen können sich endotherm oder exotherm bilden, je nach der relativen Größe der intermolekularen Anziehungskräfte zwischen dem gelösten Stoff und dem Lösungsmittel. Ideale Lösungen bilden sich ohne nennenswerte Energieänderung.
Chemie Übungen am Ende des Kapitels
- Wie unterscheiden sich Lösungen von Verbindungen? Von anderen Gemischen?
- Welche der Hauptmerkmale von Lösungen können wir in den in Abbildung 1 gezeigten Lösungen von K2Cr2O7 sehen?
- Wenn KNO3 in Wasser gelöst wird, ist die resultierende Lösung deutlich kälter als das Wasser ursprünglich war.
(a) Ist die Auflösung von KNO3 ein endothermer oder ein exothermer Prozess?
(b) Welche Schlussfolgerungen können Sie über die intermolekularen Anziehungskräfte ziehen, die an diesem Prozess beteiligt sind?
(c) Ist die entstandene Lösung eine ideale Lösung?
- Nennen Sie für jede der folgenden Lösungsarten ein Beispiel:
(a) ein Gas in einer Flüssigkeit
(b) ein Gas in einem Gas
(c) ein Feststoff in einem Feststoff
- Nennen Sie die wichtigsten Arten von zwischenmolekularen Anziehungen in jeder der folgenden Lösungen:
(a) Die Lösung in Abbildung 1.
(b) NO(l) in CO(l)
(c) Cl2(g) in Br2(l)
(d) HCl(aq) in Benzol C6H6(l)
(e) Methanol CH3OH(l) in H2O(l)
- Vorhersagen Sie, ob jeder der folgenden Stoffe besser in Wasser (polares Lösungsmittel) oder in einem Kohlenwasserstoff wie Heptan (C7H16, unpolares Lösungsmittel):
(a) Pflanzenöl (unpolar)
(b) Isopropylalkohol (polar)
(c) Kaliumbromid (ionisch)
- Bei der Bildung einiger Lösungen wird Wärme freigesetzt, bei der Bildung anderer Lösungen wird Wärme absorbiert. Erläutern Sie auf molekularer Ebene den Unterschied zwischen diesen beiden Arten von spontanen Prozessen.
- Wasserstofflösungen in Palladium können entstehen, wenn Pd-Metall H2-Gas ausgesetzt wird. Die Wasserstoffkonzentration im Palladium hängt vom Druck des H2-Gases ab, allerdings in einer komplexeren Weise, als sie durch das Henry’sche Gesetz beschrieben werden kann. Unter bestimmten Bedingungen lösen sich 0,94 g Wasserstoffgas in 215 g Palladiummetall.
(a) Bestimmen Sie die Molarität dieser Lösung (Lösungsdichte = 1,8 g/cm3).
(b) Bestimmen Sie die Molalität dieser Lösung (Lösungsdichte = 1,8 g/cm3).
(c) Bestimmen Sie den Massenanteil der Wasserstoffatome in dieser Lösung (Lösungsdichte = 1,8 g/cm3).




