Natriumchlorid
Neben den bekannten häuslichen Verwendungszwecken von Salz gehören zu den dominanteren Verwendungszwecken der rund 250 Millionen Tonnen Jahresproduktion (Daten von 2008) die chemische Industrie und die Enteisung.
ChemikalienproduktionBearbeiten
Salz wird direkt oder indirekt bei der Herstellung vieler Chemikalien verwendet, die den größten Teil der Weltproduktion verbrauchen.
ChloralkaliindustrieBearbeiten
Es ist der Ausgangspunkt für den Chloralkaliprozess, das industrielle Verfahren zur Herstellung von Chlor und Natriumhydroxid nach der chemischen Gleichung
2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
Diese Elektrolyse wird entweder in einer Quecksilberzelle, einer Diaphragmazelle oder einer Membranzelle durchgeführt. Jede dieser Zellen verwendet eine andere Methode, um das Chlor vom Natriumhydroxid zu trennen. Aufgrund des hohen Energieverbrauchs der Elektrolyse werden derzeit andere Technologien entwickelt, wobei sich kleine Verbesserungen des Wirkungsgrads wirtschaftlich stark auszahlen können. Zu den Anwendungen von Chlor gehören PVC, Desinfektionsmittel und Lösungsmittel. Natriumhydroxid ermöglicht die Herstellung von Papier, Seife und Aluminium.
Soda-IndustrieEdit
Natriumchlorid wird im Solvay-Verfahren zur Herstellung von Natriumcarbonat und Calciumchlorid verwendet. Natriumcarbonat wiederum wird zur Herstellung von Glas, Natriumbicarbonat und Farbstoffen sowie einer Vielzahl anderer Chemikalien verwendet. Im Mannheimer Verfahren und im Hargreaves-Verfahren wird Natriumchlorid für die Herstellung von Natriumsulfat und Salzsäure verwendet.
NormBearbeiten
Natriumchlorid hat eine internationale Norm, die von ASTM International erstellt wurde. Die Norm heißt ASTM E534-13 und ist die Standardtestmethoden für die chemische Analyse von Natriumchlorid. Diese aufgelisteten Methoden bieten Verfahren zur Analyse von Natriumchlorid, um festzustellen, ob es für den beabsichtigten Gebrauch und die beabsichtigte Anwendung geeignet ist.
Verschiedene industrielle VerwendungenBearbeiten
Natriumchlorid wird stark genutzt, so dass selbst relativ kleine Anwendungen große Mengen verbrauchen können. In der Erdöl- und Erdgasexploration ist Salz ein wichtiger Bestandteil von Bohrspülungen bei Brunnenbohrungen. Es wird zur Ausflockung und Erhöhung der Dichte der Bohrspülung verwendet, um den hohen Gasdruck im Bohrloch zu überwinden. Wann immer ein Bohrer auf eine Salzformation trifft, wird der Bohrspülung Salz zugesetzt, um die Lösung zu sättigen und die Auflösung innerhalb der Salzschicht zu minimieren. Salz wird auch verwendet, um die Aushärtung von Beton in zementierten Schächten zu beschleunigen.
In der Textil- und Färberei wird Salz als Spüllösung verwendet, um organische Verunreinigungen abzutrennen, das „Aussalzen“ von Farbstoffausfällungen zu fördern und mit konzentrierten Farbstoffen zu mischen, um sie zu standardisieren. Eine seiner Hauptaufgaben ist die Bereitstellung der positiven Ionenladung, um die Absorption der negativ geladenen Ionen von Farbstoffen zu fördern.
Es wird auch bei der Verarbeitung von Aluminium, Beryllium, Kupfer, Stahl und Vanadium verwendet. In der Zellstoff- und Papierindustrie wird Salz zum Bleichen von Holzzellstoff verwendet. Es wird auch zur Herstellung von Natriumchlorat verwendet, das zusammen mit Schwefelsäure und Wasser zur Herstellung von Chlordioxid, einer hervorragenden Bleichchemikalie auf Sauerstoffbasis, eingesetzt wird. Das Chlordioxidverfahren, das nach dem Ersten Weltkrieg in Deutschland entwickelt wurde, erfreut sich zunehmender Beliebtheit, da die Umwelt darauf drängt, chlorhaltige Bleichmittel zu reduzieren oder zu eliminieren. Bei der Gerbung und Lederbehandlung wird Salz den Tierhäuten zugesetzt, um die mikrobielle Aktivität auf der Unterseite der Häute zu hemmen und die Feuchtigkeit in die Häute zurückzuholen.
In der Gummiherstellung wird Salz zur Herstellung von Buna-, Neopren- und weißem Gummi verwendet. Salzsole und Schwefelsäure werden verwendet, um einen emulgierten Latex aus chloriertem Butadien zu koagulieren.
Salz wird auch zugesetzt, um den Boden zu sichern und dem Fundament, auf dem Autobahnen gebaut werden, Festigkeit zu verleihen. Natriumchlorid wird aufgrund seiner hygroskopischen Eigenschaften manchmal als billiges und sicheres Trockenmittel verwendet, was das Salzen in der Vergangenheit zu einer wirksamen Methode der Lebensmittelkonservierung gemacht hat; das Salz entzieht den Bakterien durch osmotischen Druck Wasser und hindert sie so an der Vermehrung, einer der Hauptursachen für den Verderb von Lebensmitteln. Obwohl es wirksamere Trockenmittel gibt, sind nur wenige davon für den Menschen unbedenklich.
WasserenthärtungEdit
Hartes Wasser enthält Kalzium- und Magnesiumionen, die die Wirkung von Seife beeinträchtigen und zur Bildung von Kesselstein oder einem Film aus alkalischen Mineralablagerungen in Haushalts- und Industriegeräten und -leitungen beitragen. Gewerbliche und private Wasserenthärtungsanlagen verwenden Ionenaustauscherharze, um die schädlichen Ionen, die die Härte verursachen, zu entfernen. Diese Harze werden mit Natriumchlorid erzeugt und regeneriert.
StreusalzBearbeiten
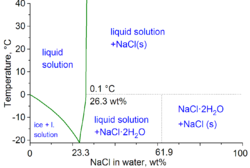
Die zweite wichtige Anwendung von Salz ist das Auftauen und der Frostschutz von Straßen, sowohl in Streugutbehältern als auch durch Winterdienstfahrzeuge. Vor dem Schneefall werden die Straßen am besten mit Sole (konzentrierte Salzlösung in Wasser) „enteist“, was die Bindung zwischen dem Schneeeis und der Straßenoberfläche verhindert. Durch dieses Verfahren wird der starke Einsatz von Salz nach dem Schneefall überflüssig. Zum Auftauen werden Mischungen aus Sole und Salz verwendet, manchmal mit zusätzlichen Mitteln wie Kalziumchlorid und/oder Magnesiumchlorid. Die Verwendung von Salz oder Sole wird unterhalb von -10 °C (14 °F) unwirksam.

Streusalz im Vereinigten Königreich kommt überwiegend aus einer einzigen Mine in Winsford in Cheshire. Vor der Verteilung wird es mit <100 ppm Natriumferrocyanid als Antiklumpmittel gemischt, das dafür sorgt, dass das Steinsalz trotz der Lagerung vor dem Einsatz ungehindert aus den Streufahrzeugen fließen kann. In den letzten Jahren wurde dieser Zusatzstoff auch in Speisesalz verwendet. Andere Zusatzstoffe wurden im Streusalz verwendet, um die Gesamtkosten zu senken. So wurde in den USA eine Kohlenhydratlösung, die als Nebenprodukt bei der Zuckerrübenverarbeitung anfällt, mit Steinsalz gemischt und haftete auf der Straßenoberfläche um 40 % besser als loses Steinsalz allein. Da es länger auf der Straße blieb, musste die Behandlung nicht mehrmals wiederholt werden, was Zeit und Geld sparte.
In der physikalischen Chemie liegt der minimale Gefrierpunkt eines Wasser-Salz-Gemisches bei -21,12 °C (-6,02 °F) für 23,31 Gew.-% Salz. Das Gefrieren in der Nähe dieser Konzentration ist jedoch so langsam, dass der eutektische Punkt von -22,4 °C (-8,3 °F) bei etwa 25 Gew.-% Salz erreicht werden kann.
Auswirkungen auf die UmweltBearbeiten
Streusalz gelangt in Süßwasserkörper und kann Wasserpflanzen und -tiere schädigen, indem es ihre Osmoregulationsfähigkeit stört. Das allgegenwärtige Salz stellt ein Problem bei allen Küstenanstrichen dar, da die eingeschlossenen Salze große Probleme bei der Haftung verursachen. Schifffahrtsbehörden und Schiffsbauer überwachen die Salzkonzentrationen auf den Oberflächen während des Baus. Die maximalen Salzkonzentrationen auf den Oberflächen hängen von der Behörde und der Anwendung ab. Am häufigsten wird die IMO-Verordnung angewandt, die den Salzgehalt auf maximal 50 mg/m2 lösliche Salze, gemessen als Natriumchlorid, festlegt. Diese Messungen werden mit Hilfe eines Bresle-Tests durchgeführt. Die Versalzung (zunehmender Salzgehalt, auch Süßwasserversalzungssyndrom genannt) und die daraus resultierende verstärkte Auswaschung von Metallen ist ein ständiges Problem in ganz Nordamerika und in den europäischen Binnengewässern.
Bei der Enteisung von Autobahnen wurde Salz mit der Korrosion von Brückendecks, Kraftfahrzeugen, Bewehrungsstäben und -drähten sowie ungeschützten Stahlkonstruktionen im Straßenbau in Verbindung gebracht. Oberflächenabfluss, das Sprühen von Fahrzeugen und Windverwehungen beeinträchtigen auch den Boden, die Vegetation am Straßenrand und die örtlichen Oberflächen- und Grundwasservorräte. Obwohl während der Spitzenbelastungen Anzeichen für eine Belastung der Umwelt durch Salz gefunden wurden, verdünnen die Regenfälle und das Tauwetter im Frühjahr in der Regel die Natriumkonzentrationen in dem Gebiet, in dem das Salz ausgebracht wurde. Eine Studie aus dem Jahr 2009 ergab, dass etwa 70 % des im Großraum Minneapolis-St. Paul ausgebrachten Streusalzes im örtlichen Wassereinzugsgebiet zurückgehalten wird.
SubstitutionBearbeiten
Einige Behörden ersetzen Streusalz durch Bier, Melasse und Rübensaft. Fluggesellschaften verwenden mehr Glykol und Zucker als salzbasierte Lösungen zum Enteisen.
Lebensmittelindustrie und LandwirtschaftBearbeiten
Viele Mikroorganismen können in einer salzhaltigen Umgebung nicht leben: Sie entziehen ihren Zellen durch Osmose Wasser. Aus diesem Grund wird Salz zur Konservierung einiger Lebensmittel wie Speck, Fisch oder Kohl verwendet.
Salz wird Lebensmitteln entweder vom Hersteller oder vom Verbraucher als Geschmacksverstärker, Konservierungsmittel, Bindemittel, Gärungshemmer, Texturkontrollmittel und Farbentwickler zugesetzt. Der Salzverbrauch in der Lebensmittelindustrie unterteilt sich in absteigender Reihenfolge des Verbrauchs in die Bereiche sonstige Lebensmittelverarbeitung, Fleischverpackungen, Konserven, Backwaren, Molkereiprodukte und Getreidemühlen. Salz wird zugesetzt, um die Farbentwicklung von Speck, Schinken und anderen verarbeiteten Fleischprodukten zu fördern. Als Konservierungsmittel hemmt Salz das Wachstum von Bakterien. In Wurstwaren bildet Salz als Bindemittel ein Gel, das sich aus Fleisch, Fett und Feuchtigkeit zusammensetzt. Salz wirkt auch als Geschmacksverstärker und als Weichmacher.
In vielen Molkereien wird Salz dem Käse als Farb-, Gärungs- und Texturkontrollmittel zugesetzt. Der Teilsektor Molkereiprodukte umfasst Unternehmen, die Molkereibutter, Kondens- und Kondensmilch, gefrorene Desserts, Eiscreme, Natur- und Schmelzkäse sowie spezielle Molkereiprodukte herstellen. In der Konservenindustrie wird Salz hauptsächlich als Geschmacksverstärker und Konservierungsmittel eingesetzt. Es wird auch als Trägerstoff für andere Zutaten, als Trocknungsmittel, Enzyminhibitor und Weichmacher verwendet. Beim Backen wird Salz zugesetzt, um die Gärungsgeschwindigkeit des Brotteigs zu steuern. Außerdem wird es zur Stärkung des Glutens (des elastischen Eiweiß-Wasser-Komplexes in bestimmten Teigen) und als Geschmacksverstärker verwendet, z. B. als Topping auf Backwaren. Die Kategorie Lebensmittelverarbeitung umfasst auch Getreidemühlenprodukte. Diese Produkte bestehen aus dem Mahlen von Mehl und Reis und der Herstellung von Frühstücksflocken und gemischtem oder zubereitetem Mehl. Salz wird auch als Würzmittel verwendet, z. B. in Kartoffelchips, Brezeln, Katzen- und Hundefutter.
Natriumchlorid wird in der Veterinärmedizin als Brechmittel verwendet. Es wird als warme, gesättigte Lösung verabreicht. Erbrechen kann auch durch die pharyngeale Verabreichung einer kleinen Menge von Kochsalz oder Salzkristallen ausgelöst werden.
MedizinBearbeiten
Natriumchlorid wird zusammen mit Wasser als eine der wichtigsten Lösungen für die intravenöse Therapie verwendet. Nasenspray enthält oft eine Kochsalzlösung.
BrandbekämpfungEdit

Natriumchlorid ist das Hauptlöschmittel in Feuerlöschern (Met-L-X, Super D), die bei Bränden von brennbaren Metallen wie Magnesium, Kalium, Natrium und NaK-Legierungen (Klasse D) eingesetzt werden. Dem Gemisch wird thermoplastisches Pulver zugesetzt, das zusammen mit wasserabweisenden (Metallstearate) und verbackungshemmenden Materialien (Tricalciumphosphat) das Löschmittel bildet. Wenn es auf das Feuer aufgebracht wird, wirkt das Salz wie ein Kühlkörper, der die Hitze des Feuers ableitet, und bildet außerdem eine sauerstoffausschließende Kruste, die das Feuer erstickt. Der Kunststoffzusatz schmilzt und hilft der Kruste, ihre Integrität zu bewahren, bis das brennende Metall unter seine Entzündungstemperatur abgekühlt ist. Diese Art von Feuerlöscher wurde in den späten 1940er Jahren als patronenbetriebenes Gerät erfunden, obwohl heute auch Versionen mit gespeichertem Druck beliebt sind. Übliche Größen sind 14 kg (30 Pfund) tragbar und 160 kg (350 Pfund) auf Rädern.
ReinigungsmittelBearbeiten
Seit mindestens dem Mittelalter haben die Menschen Salz als Reinigungsmittel verwendet, mit dem sie die Oberflächen im Haushalt einreiben. Es wird auch in vielen Shampoo- und Zahnpastamarken verwendet und ist beliebt, um Einfahrten und Eisflächen zu enteisen.
Optische VerwendungEdit
Defektfreie NaCl-Kristalle haben eine optische Durchlässigkeit von etwa 90 % für Infrarotlicht, insbesondere zwischen 200 nm und 20 µm. Sie wurden daher für optische Komponenten (Fenster und Prismen) verwendet, die in diesem Spektralbereich arbeiten, in dem es nur wenige nicht absorbierende Alternativen gibt und in dem die Anforderungen an die Abwesenheit mikroskopischer Inhomogenitäten weniger streng sind als im sichtbaren Bereich. NaCl-Kristalle sind zwar preiswert, aber weich und hygroskopisch – wenn sie der Umgebungsluft ausgesetzt werden, bilden sie allmählich eine „Reifschicht“. Dies beschränkt die Anwendung von NaCl auf trockene Umgebungen, vakuumversiegelte Montagebereiche oder für kurzfristige Anwendungen wie die Herstellung von Prototypen. Heutzutage werden Materialien wie Zinkselenid (ZnSe), die mechanisch stärker und weniger feuchtigkeitsempfindlich sind, anstelle von NaCl für den Infrarot-Spektralbereich verwendet.




