Natriumchlorid, NaCl
Der klassische Fall einer Ionenbindung: Das Natriumchloridmolekül entsteht durch die Ionisierung von Natrium- und Chloratomen und die Anziehung der entstehenden Ionen.
Ein Natriumatom hat ein 3s-Elektron außerhalb einer geschlossenen Schale, und es erfordert nur 5,14 Elektronenvolt an Energie, um dieses Elektron zu entfernen. Dem Chlor fehlt ein Elektron, um eine Schale zu füllen, und es gibt 3,62 eV ab, wenn es dieses Elektron erwirbt (seine Elektronenaffinität beträgt 3,62 eV). Das bedeutet, dass es nur 1,52 eV an Energie benötigt, um eines der Natriumelektronen an das Chlor zu spenden, wenn sie weit voneinander entfernt sind. Wenn die beiden Ionen näher zusammengebracht werden, wird ihre elektrische potentielle Energie immer negativer und erreicht -1,52 eV bei einem Abstand von etwa 0,94 nm. Das heißt, wenn sich neutrale Natrium- und Chloratome näher als 0,94 nm befinden, wäre es energetisch günstig, ein Elektron von Na auf Cl zu übertragen und die Ionenbindung zu bilden.
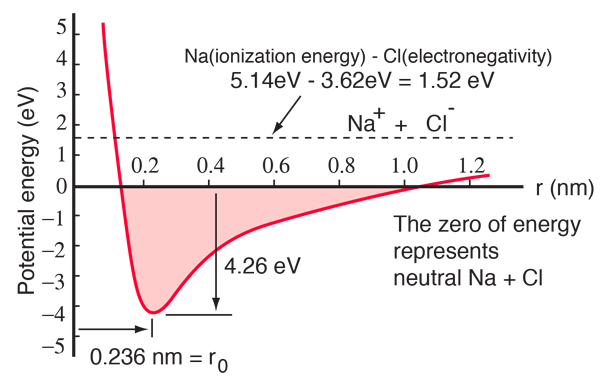
Die Kurve der potentiellen Energie zeigt, dass es ein Minimum bei 0,236 nm Abstand und dann einen steilen Anstieg des Potentials gibt, was eine abstoßende Kraft darstellt. Diese abstoßende Kraft ist mehr als nur eine elektrostatische Abstoßung zwischen den Elektronenwolken der beiden Atome. Sie hat einen quantenmechanischen Charakter, der auf dem Pauli-Ausschlussprinzip beruht, und wird oft einfach als „Ausschlussprinzip-Abstoßung“ bezeichnet. Wenn die Ionen weit voneinander entfernt sind, überlappen sich die Wellenfunktionen ihrer Kernelektronen nicht wesentlich, und sie können identische Quantenzahlen haben. Mit zunehmender Annäherung führt die zunehmende Überlappung der Wellenfunktionen dazu, dass einige in höhere Energiezustände gezwungen werden. Da keine zwei Elektronen denselben Zustand einnehmen können, werden bei der Bildung eines neuen Satzes von Energiezuständen für das zusammengesetzte System mit zwei Kernen die niedrigeren Energiezustände aufgefüllt und einige der Elektronen in höhere Zustände gedrängt. Dies erfordert Energie und wird als Abstoßung empfunden, die verhindert, dass sich die Ionen einander weiter annähern.
Das obige Potenzialdiagramm bezieht sich auf gasförmiges NaCl; im normalen festen Zustand, in dem Natriumchlorid (Kochsalz) kubische Kristalle bildet, ist die Umgebung anders. Der Abstand der Ionen beträgt 0,28 nm und ist damit etwas größer als im gasförmigen Zustand.
Ein wichtiger Teil der Untersuchung der Molekülstruktur ist die Beschreibung der chemischen Bindungen, die zwischen den Atomen gebildet werden. Die klassischen Studien sind die Extreme der ionischen Bindung in Natriumchlorid und der kovalenten Bindung im Wasserstoffmolekül.
| Chemische Bindungen | Pauli-Abstoßung in ionischen Bindungen |
Bindungsenergiebeispiel




