Enzymremming
Enzymen zijn nodig voor de meeste, zo niet alle, processen die voor het leven nodig zijn. Enzymen katalyseren een reactie door de activeringsenergie te verminderen die nodig is om de reactie te laten plaatsvinden. Enzymen moeten echter strak worden gereguleerd om ervoor te zorgen dat het niveau van het product niet tot ongewenste niveaus stijgt. Dit wordt bereikt door remming van enzymen.
Typen remming
Reversibele en irreversibele remmers zijn chemische stoffen die zich aan een enzym binden om de activiteit ervan te onderdrukken. Een methode om dit te bereiken is een bijna permanente binding met een enzym. Dit soort remmers wordt onomkeerbaar genoemd. Andere chemische stoffen kunnen zich echter tijdelijk aan een enzym binden. Deze worden omkeerbaar genoemd. Reversibele remmers binden zich ofwel aan een actieve plaats (competitieve remmers), ofwel aan een andere plaats op het enzym (niet-competitieve remmers).
 Fig 1 – Schematische weergave van het effect van competitieve en niet-competitieve enzymremmers.
Fig 1 – Schematische weergave van het effect van competitieve en niet-competitieve enzymremmers.Competitieve remmers
Competitieve remmers concurreren met het substraat op de actieve plaats, en verhogen daardoor Km (de Michaelis-Menten-constante). De Vmax blijft echter ongewijzigd, omdat de reactie bij voldoende substraatconcentratie nog steeds kan worden voltooid. De grafiek van de enzymactiviteit tegen de substraatconcentratie zou naar rechts opschuiven door de toename van de Km, terwijl de Lineweaver-Burke-grafiek steiler zou zijn in vergelijking met die zonder remmer.
Niet-competitieve remmers
Niet-competitieve remmers binden zich aan een andere plaats op het enzym en verlagen als zodanig VMAX. KM blijft echter ongewijzigd. Dit blijkt uit een lager maximum op een grafiek waarin de enzymactiviteit wordt uitgezet tegen de substraatconcentratie en een hoger y-intercept op een Lineweaver-Burke-grafiek in vergelijking met geen remmer.
| Competitief | Niet-Competitief | |
| Waar werkt het? | Actieve plaats | Alternatieve plaats |
| Wijziging van Km | Verhoging | Niet gewijzigd |
| Wijziging van Vmax | Gewijzigd | Verlaging |
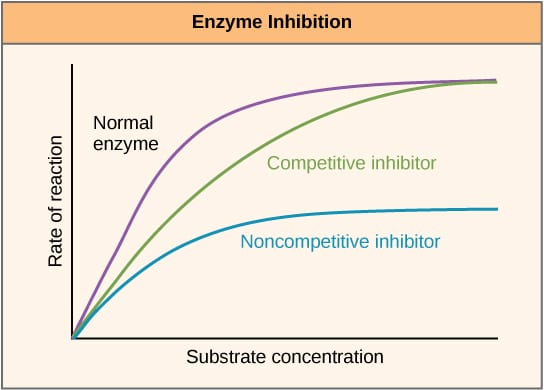 Fig 2 – Fig. 2. Schematische weergave van het effect van enzymremmers op de reactiesnelheid en hoe deze varieert met de substraatconcentratie.
Fig 2 – Fig. 2. Schematische weergave van het effect van enzymremmers op de reactiesnelheid en hoe deze varieert met de substraatconcentratie.Allosterische remming
Allosterische enzymen vertonen een sigmoïdale curve, in tegenstelling tot de hyperboolcurve bij Michaelis-Menten-enzymen. Dit komt doordat de meeste allosterische enzymen meerdere subeenheden bevatten die elkaar kunnen beïnvloeden wanneer het substraat zich aan het enzym bindt. Inhibitie kan van invloed zijn op K0.5, de substraatconcentratie voor halfverzadiging, op Vmax of op beide. Dit resulteert in een verschuiving van de curve naar rechts, en in het geval van verlaging van Vmax, verschuift de curve naar beneden.
Allosterische enzymen hebben twee toestanden: een toestand met lage affiniteit die de “T”-toestand wordt genoemd en de “R”-toestand met hoge affiniteit. Inhibitoren werken door bij voorkeur te binden aan de T-toestand van een allosterisch enzym, waardoor het enzym deze lage affiniteitstoestand behoudt.
Dit is uiterst nuttig om de hoeveelheid van het product van een enzym te beperken, aangezien het product vervolgens hetzelfde type enzym kan gaan remmen om ervoor te zorgen dat de hoeveelheid product niet te groot is. Dit staat bekend als terugkoppelingsremming. ATP bijvoorbeeld remt allosterisch pyruvaat kinase om een verhoogde vorming van pyruvaat te voorkomen, zodat uiteindelijk minder ATP wordt gevormd. Bovendien wordt fosfofructokinase allosterisch geremd door citraat, een tussenproduct van de Kreb’s cyclus. Dit betekent dat de glycolyse wordt beperkt wanneer er veel ATP uit de cyclus van Kreb wordt gevormd.
 Fig 3 – Schema dat het mechanisme van zowel allosterische remming als activering laat zien.
Fig 3 – Schema dat het mechanisme van zowel allosterische remming als activering laat zien.Fosforylering
Fosforylering is een ander mechanisme waarmee enzymen kunnen worden geremd. Dit gebeurt meestal door de werking van kinase-enzymen, die een enzym kunnen remmen of activeren, afhankelijk van de situatie. De kinase-enzymen splitsen een fosfaatgroep van ATP af en binden deze aan het enzym. In situaties waarin dit resulteert in een toename van de enzymactiviteit ontstaat een cascadereactie, waardoor uit een kleine prikkel een grote reactie kan worden opgewekt.
Zymogenen
Enzymen kunnen ook in een inactieve toestand worden uitgescheiden, die zymogenen worden genoemd. Zymogenen zijn een nuttig mechanisme waarmee enzymen veilig naar verschillende locaties kunnen worden getransporteerd, zonder dat het enzym onderweg actief wordt en zijn functie uitvoert. Zij blijven inactief door een toevoeging van aminozuren in het eiwit. Daarom moet, om een zymogeen te activeren, een ander enzym deze extra aminozuren afsplitsen. Zo wordt chymotrypsinogeen bijvoorbeeld gesynthetiseerd door de alvleesklier, maar het is geïnactiveerd en kan niet functioneren. Op weg naar de darmen splitst een ander enzym (trypsine) de extra aminozuren af om de geactiveerde vorm, chymotripsine, te produceren.
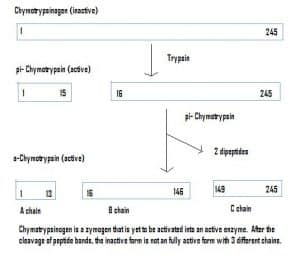 Fig 4 – Schematische weergave van de activering van chymotrypsinogeen in het maag-darmstelsel en de enzymen die daarbij in elk stadium betrokken zijn.
Fig 4 – Schematische weergave van de activering van chymotrypsinogeen in het maag-darmstelsel en de enzymen die daarbij in elk stadium betrokken zijn.Klinische relevantie – Farmacokinetiek
De belangrijkste klinische toepassing van enzymremming is het gebruik van farmaceutische geneesmiddelen. ACE-remmers zijn een gebruikelijke behandeling voor hypertensie. Angiotensine I wordt omgezet in Angiotensine II door de werking van Angiotensine Converting Enzyme (ACE). Angiotensine II veroorzaakt echter talrijke effecten die verband houden met een verhoging van de bloeddruk. Daarom werden ACE-remmers ontworpen om de werking van ACE competitief te remmen, hetgeen resulteert in minder Angiotensine II-vorming en een lagere bloeddruk.
Penicilline bindt zich op onomkeerbare wijze aan de actieve site van een enzym dat DD-transpeptidase wordt genoemd. DD-transpeptidase is verantwoordelijk voor de laatste stap van de synthese van de bacteriële celwand. Door remming van dit enzym kunnen de bacteriën geen celwand synthetiseren en dus niet in leven blijven.
Finitief is cyanide een voorbeeld van een niet-concurrerende remmer. Cyanide bindt zich aan het laatste enzym in de elektronentransportketen en verhindert dat dit enzym de reactie van zuurstof naar water katalyseert. Hierdoor kunnen geen elektronen meer door de elektronentransportketen stromen en kan geen ATP worden gegenereerd, wat de dood tot gevolg heeft.




