CHEM 245 – Inhibición enzimática
Temas de bioquímica
Inhibición enzimática
Tipos de inhibidores e inhibición.Inhibidores e inhibición reversibles e irreversibles. Modelos y efectos cinéticos de la inhibición competitiva y no competitiva. Inhibición mixta.Ejemplos de inhibición enzimática.
La especificidad de las enzimas no se limita estrictamente a los sustratos. A menudo, la actividad de una enzima se reduce por interacciones específicas con moléculas denominadas inhibidores. La inhibición de las enzimas es uno de los fenómenos más importantes de la bioquímica. Por ejemplo, muchos fármacos, antibióticos y toxinas ejercen sus efectos por su capacidad de inhibir una enzima. Los inhibidores que son estructuralmente similares al sustrato suelen ser inhibidores competitivos, ya que compiten por unirse al sitio activo. La inhibición de la enzima puede ser reversible (como suele ser el caso cuando un inhibidor se une a la enzima a través de interacciones no covalentes) o irreversible (como ocurre en numerosos casos en los que los inhibidores actúan a través de modificaciones covalentes en la enzima, quizás apuntando a un residuo crítico para la catálisis).
Podemos imaginar varios modelos sencillos para la inhibición reversible. El más sencillo es la oclusión directa del sitio activo por el inhibidor. Esto se vería en el caso de una molécula con cierta similitud estructural con el sustrato. La unión del sustrato y del inhibidor son mutuamente excluyentes en este modelo de inhibición competitiva.
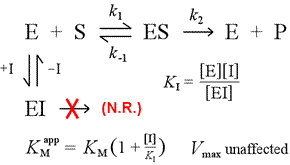
A la derecha se muestra un modelo mecanístico simple para la inhibición competitiva. El inhibidor, I, se une sólo a la enzima libre E, con una constante de disociación KI , y bloquea la unión del sustrato (S). Al atar parte de la enzima en el complejo inactivo EI, hay menos de ella disponible a una concentración de sustrato dada para combinarse con el sustrato y formar ES y luego convertirse potencialmente en productos. Se observará un aumento de lo necesario para alcanzar ½Vmax, de ahí que aumente el valor aparente de KM.
Al aumentar a niveles cada vez mayores, el sustrato puede sobrepasar al inhibidor, superando la competencia de la enzima libre hasta el punto de que la verdadera Vmax puede seguir acercándose.
Podemos imaginar fácilmente que una molécula que se parezca al sustrato en ciertas características estructurales clave podría competir con el sustrato para unirse al sitio activo. Esto se llama un análogo del sustrato, y proporcionan ejemplos comunes de inhibidores competitivos de las enzimas. Si la forma en que las enzimas mejoran las tasas de reacción es estabilizando selectivamente el estado de transición de la reacción, entonces si podemos encontrar una molécula que se parezca al estado de transición (en estructura y polaridad o carga), tal análogo del estado de transición debería ser un muy buen inhibidor competitivo.
Contrastaremos el modelo de inhibición competitiva con la inhibición no competitiva, en la que el inhibidor se une sólo al complejo enzima-sustrato. Uno puede imaginar que esto ocurre como resultado de una interacción enzima-sustrato de tipo inducido, en la que un sitio de unión para un inhibidor está disponible exclusivamente en la conformación inducida de ES.
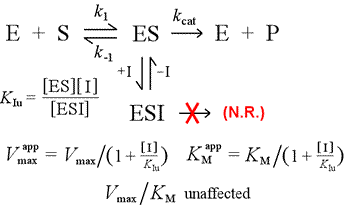
Izquierda: Un modelo mecanístico para la inhibición no competitiva. En este modelo, el inhibidor se une sólo al complejo ES, y no a la enzima libre. El complejo ternario, ESI, no pasa a productos. Esto tiene el efecto de reducir la Vmax aparente. La constante de disociación del inhibidor para la ESI se denomina KIu. En un efecto explicado por el Principio de Le Châtelier, la KM aparente es menor, ya que la unión del inhibidor elimina parte del producto (ES) del «equilibrio» de formación del ES.
Un modelo de inhibición en el que el inhibidor se une tanto a la enzima libre como al complejo enzima-sustrato es la inhibición mixta. La constante de disociación del inhibidor puede diferir entre E y ES (es decir, KI ≠ KIu). El caso especial en el que KI = KIu recibe el nombre de inhibición no competitiva. Obsérvese que en este caso, la KM no se ve afectada, mientras que la Vmax disminuye.
Tipos de inhibición enzimática reversible – un resumen
Hemos visto que los diferentes modelos de inhibición reversible pueden distinguirse según los efectos sobre los parámetros cinéticos. La siguiente tabla resume los tipos de inhibición y sus efectos sobre estos parámetros.

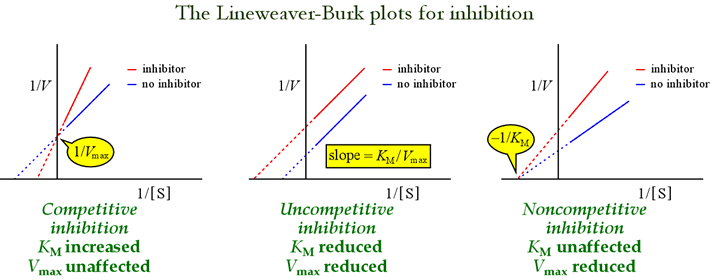
Los gráficos de Lineweaver-Burk, o de doble reciprocidad, son útiles para identificar los patrones de inhibición. La figura de abajo showshow diferentes tipos de inhibición afectan a la trama.
Ejemplos de inhibición enzimática
El primer y más extendido fármaco, el acetilsalicilato (salicilato = ortohidroxibenzoato), comúnmente conocido como aspirina, es un eficaz analgésico (calmante del dolor), antipirético (reductor de la fiebre) y agente antiinflamatorio. Las propiedades medicinales de la corteza de sauce se conocían en algunas culturas desde hace siglos. En el siglo XIX se descubrió que el ingrediente activo era una combinación de alcohol salicílico. A partir de estas y otras observaciones, así como de los avances en la síntesis química, la aspirina empezó a estar disponible a mediados de siglo, tras ser preparada por Hoffman, un químico empleado por Bayer. Investigaciones más modernas han establecido que las propiedades medicinales de la aspirina se derivan en gran medida de su capacidad para inhibir de forma irreversible una enzima conocida como ciclooxigenasa, necesaria para la síntesis de prostaglandinas y tromboxanos.
Las ciclooxigenasas catalizan el primer paso en la conversión del araquidonato en un precursor de las prostaglandinas y los tromboxanos, la prostaglandina G2 (PGG2, estructuras y reacción). La reacción utiliza dos moléculas de O2 y convierte el ácido graso C20:4 en una molécula peroxidada que contiene un anillo de ciclopentano (PGG2 – PG significa «prostaglandina»). La enzima ciclooxigenasa también posee una actividad hidroperoxidasa que convierte la PGG2 en PGH2. Por lo tanto, la «ciclooxigenasa» (COX) se designaría más exactamente como prostaglandina endoperóxido H sintasa (PGHS). La inhibición de la actividad de la ciclooxigenasa por la aspirina se debe a su capacidad de modificar químicamente un residuo de serina (Ser530) de la enzima. El residuo de serina adquiere un grupo acetilo de la aspirina, una modificación irreversible. Así pues, la aspirina es un ejemplo de inhibidor irreversible. En realidad, existen dos isozimas de la COX: una forma constitutiva, la COX-1 (PGHS-1), y una forma inducida (en condiciones de inflamación), la COX-2 (PGHS-2). Los antiinflamatorios no esteroideos (AINE), como la aspirina, el ibuprofeno y el naproxeno, suelen inhibir ambas isoformas. En consecuencia, estos fármacos producen efectos secundarios no deseados, por ejemplo, irritación gastrointestinal. Por ello, un objetivo actual de la investigación farmacológica es desarrollar inhibidores específicos para la COX-2, un efecto que se cree que media la mayor parte de los efectos analgésicos y antiinflamatorios de los AINE.
Páginas de temas relacionados:
- Cinética química introductoria
- Enzimología introductoria
- Cinética enzimática
- Ecuación de Michaelis-Menten




