Inhibición enzimática
Las enzimas son necesarias para la mayoría, si no todos, los procesos necesarios para la vida. Las enzimas catalizan una reacción reduciendo la energía de activación necesaria para que ésta se produzca. Sin embargo, las enzimas deben estar estrechamente reguladas para garantizar que los niveles del producto no aumenten hasta niveles no deseados. Esto se consigue mediante la inhibición enzimática.
Tipos de inhibición
Los inhibidores reversibles e irreversibles son sustancias químicas que se unen a una enzima para suprimir su actividad. Un método para lograr esto es unirse casi permanentemente a una enzima. Este tipo de inhibidores se denominan irreversibles. Sin embargo, otras sustancias químicas pueden unirse a una enzima de forma transitoria. Se denominan reversibles. Los inhibidores reversibles se unen a un sitio activo (inhibidores competitivos) o a otro sitio de la enzima (inhibidores no competitivos).
 Fig. 1 – Diagrama para mostrar el efecto de los inhibidores enzimáticos competitivos y no competitivos.
Fig. 1 – Diagrama para mostrar el efecto de los inhibidores enzimáticos competitivos y no competitivos.Inhibidores competitivos
Los inhibidores competitivos compiten con el sustrato en el sitio activo y, por tanto, aumentan la Km (la constante de Michaelis-Menten). Sin embargo, la Vmax no cambia porque, con una concentración suficiente de sustrato, la reacción puede seguir completándose. El gráfico de la actividad de la enzima frente a la concentración de sustrato se desplazaría hacia la derecha debido al aumento de la Km, mientras que el gráfico de Lineweaver-Burke sería más pronunciado en comparación con la ausencia de inhibidores.
Inhibidores no competitivos
Los inhibidores no competitivos se unen a otro lugar de la enzima y, por tanto, disminuyen la VMAX. Sin embargo, el KM no cambia. Esto se demuestra por un máximo más bajo en un gráfico que representa la actividad de la enzima frente a la concentración de sustrato y una intersección y más alta en un gráfico de Lineweaver-Burke cuando se compara con la ausencia de inhibidor.
| Competitivo | No competitivo | |
| ¿Dónde actúa? | Sitio activo | Sitio alternativo |
| Cambio de Km | Aumento | Sin cambios |
| Cambio de Vmax | Sin cambios | Disminución |
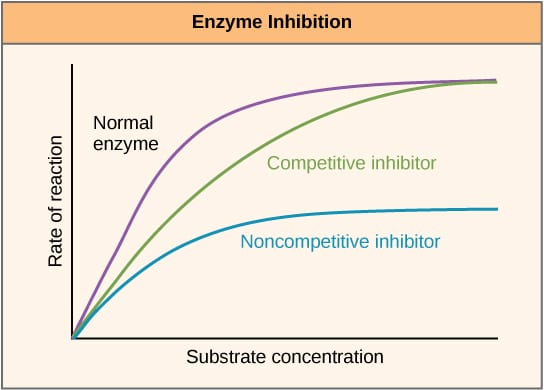 Fig 2 – Diagrama para mostrar el efecto de los inhibidores de la enzima en la velocidad de reacción y cómo varía con la concentración de sustrato.
Fig 2 – Diagrama para mostrar el efecto de los inhibidores de la enzima en la velocidad de reacción y cómo varía con la concentración de sustrato.Inhibición alostérica
Las enzimas alostéricas muestran una curva sigmoidal en contraste con la curva hiperbólica que muestran las enzimas de Michaelis-Menten. Esto se debe a que la mayoría de las enzimas alostéricas contienen múltiples subunidades que pueden afectarse mutuamente cuando el sustrato se une a la enzima. La inhibición puede afectar a K0.5, que es la concentración de sustrato para la media saturación, a Vmax o a ambas. Esto provoca un desplazamiento de la curva hacia la derecha y, en el caso de la reducción de la Vmax, desplaza la curva hacia abajo.
Las enzimas alostéricas tienen dos estados: un estado de baja afinidad denominado estado «T» y el estado de alta afinidad «R». Los inhibidores actúan uniéndose preferentemente al estado T de una enzima alostérica, haciendo que la enzima mantenga este estado de baja afinidad.
Esto es extremadamente útil para limitar la cantidad de producto de una enzima, ya que el producto puede pasar a inhibir el mismo tipo de enzima para garantizar que la cantidad de producto no sea excesiva. Esto se conoce como inhibición por retroalimentación. Por ejemplo, el ATP inhibe alostéricamente a la piruvato quinasa para evitar una mayor formación de piruvato, por lo que finalmente se forma menos ATP. Además, la fosfofructoquinasa es inhibida alostéricamente por el citrato, un intermediario del ciclo de Kreb. Esto significa que la glucólisis estará limitada cuando haya una alta generación de ATP a partir del ciclo de Kreb.
 Fig 3 – Diagrama para mostrar el mecanismo tanto de la inhibición alostérica como de la activación.
Fig 3 – Diagrama para mostrar el mecanismo tanto de la inhibición alostérica como de la activación.Fosforilación
La fosforilación proporciona otro mecanismo por el cual las enzimas pueden ser inhibidas. Esto ocurre típicamente a través de la acción de las enzimas quinasas, que pueden inhibir o activar una enzima dependiendo de la situación. Las enzimas quinasas escinden un grupo fosfato del ATP y lo unen a la enzima. En situaciones en las que esto da lugar a un aumento de la actividad enzimática, se crea una reacción en cascada que permite generar una gran respuesta a partir de un pequeño estímulo.
Zimógenos
Las enzimas también pueden ser secretadas en un estado inactivo, que se denominan zimógenos. Los zimógenos son un mecanismo útil que permite transportar las enzimas de forma segura a diferentes lugares, sin que la enzima se active y realice su función por el camino. Permanecen inactivos debido a una adición de aminoácidos en la proteína. Por lo tanto, para activar un zimógeno, otra enzima debe escindir estos aminoácidos adicionales. Por ejemplo, el quimotripsinógeno es sintetizado por el páncreas, pero está inactivado y no puede funcionar. Al llegar a los intestinos, otra enzima (tripsina) escinde los aminoácidos adicionales para producir la forma activada, la quimotripsina.
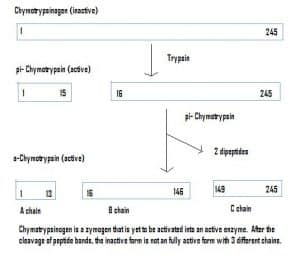 Fig. 4 – Diagrama que muestra la activación del quimotripsinógeno en el sistema gastrointestinal y las enzimas que intervienen en cada etapa.
Fig. 4 – Diagrama que muestra la activación del quimotripsinógeno en el sistema gastrointestinal y las enzimas que intervienen en cada etapa.Relevancia clínica – Farmacocinética
El uso clínico más importante de la inhibición enzimática es el uso de fármacos. Los inhibidores de la ECA son un tratamiento común para la hipertensión. La angiotensina I se convierte en angiotensina II por la acción de la enzima convertidora de angiotensina (ECA). Sin embargo, la angiotensina II provoca numerosos efectos relacionados con el aumento de la presión arterial. Por lo tanto, los inhibidores de la ECA se diseñaron para inhibir de forma competitiva la acción de la ECA, lo que da lugar a una menor formación de angiotensina II y a una disminución de la presión arterial.
Alternativamente, la penicilina se une de forma irreversible al sitio activo de una enzima denominada DD-transpeptidasa. La DD-transpeptidasa es responsable del último paso de la síntesis de la pared celular bacteriana. Al inhibir esta enzima, las bacterias no pueden sintetizar una pared celular y, por tanto, no pueden mantener la vida.
Por último, el cianuro es un ejemplo de inhibidor no competitivo. El cianuro se une a la última enzima de la cadena de transporte de electrones e impide que esta enzima catalice la reacción del oxígeno al agua. Esto impide el flujo de electrones por la cadena de transporte de electrones y no se puede generar ATP, lo que provoca la muerte.




