3.3: Subatomiset hiukkaset – elektronit, protonit ja neutronit
Subatomisten hiukkasten tunnistaminen ja paikantaminen
Vuonna 1897 brittiläinen fyysikko J. J. Thomson (1856-1940) osoitti, että atomit eivät ole aineen alkeellisin muoto. Hänen kokeissaan käytettiin katodisädeputkia (CRT). Nämä laitteet tuottavat alipaineistetussa ympäristössä näkymättömiä säteitä, jotka lähtevät negatiivisesta elektrodista (katodi) ja jatkuvat positiiviseen elektrodiin (anodi). Näissä kokeissa Thomson osoitti, että katodisäteet voidaan poikkeuttaa tai taivuttaa magneetti- tai sähkökentillä, mikä osoitti, että katodisäteet koostuvat varatuista hiukkasista. Vielä tärkeämpää oli, että Thomson pystyi laskemaan hiukkasten massan ja varauksen suhteen mittaamalla katodisäteiden taipumisen laajuuden eri vahvuisissa magneetti- tai sähkökentissä. Koska samankaltaiset varaukset hylkivät toisiaan ja vastakkaiset varaukset vetävät toisiaan puoleensa, Thomson päätteli, että hiukkasilla oli nettomääräinen negatiivinen varaus; näitä hiukkasia kutsutaan nyt elektroneiksi. Kemiaa ajatellen Thomson havaitsi, että katodisäteiden massa-lataussuhde on riippumaton metallielektrodien tai kaasun luonteesta, mikä viittasi siihen, että elektronit olivat kaikkien atomien peruskomponentteja.
1910-luvulla röntgensäteillä tehdyt kokeet johtivat tähän hyödylliseen johtopäätökseen: tietyn alkuaineen jokaisen atomin ytimen positiivisen varauksen suuruus on sama. Toisin sanoen kaikilla saman alkuaineen atomeilla on sama määrä protoneja. Lisäksi eri alkuaineilla on eri määrä protoneja ytimissään, joten protonien määrä atomin ytimessä on ominaista tietylle alkuaineelle. Tämä löytö oli niin tärkeä atomeja koskevan ymmärryksemme kannalta, että atomin ytimessä olevien protonien lukumäärää kutsutaan atomiluvuksi. Nämä kokeet suoritti Ernest Rutherford. Hänen ansiokseen on luettu atomin keskeisen paikan määrittäminen, joka on nykyään nimetty ytimeksi.
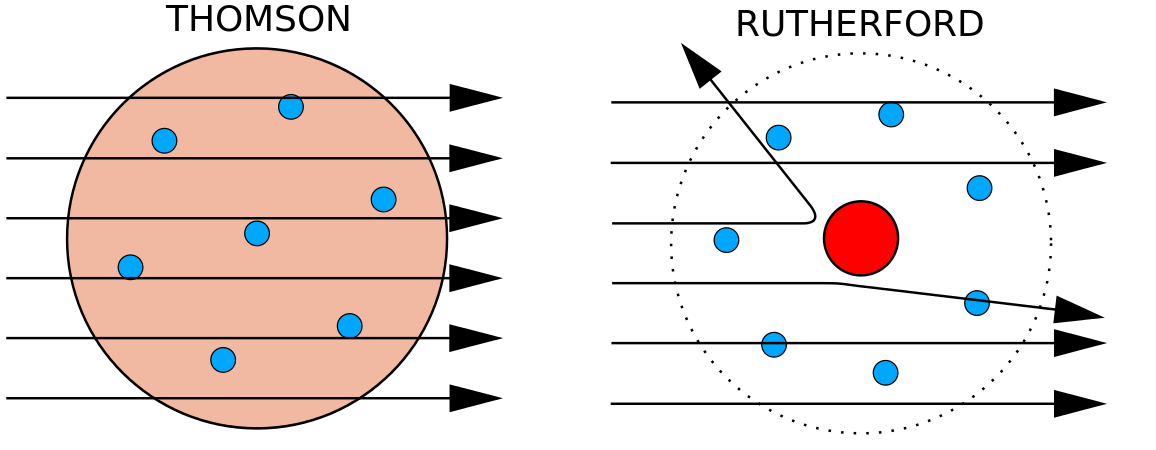
Rutherford oli tietoinen siitä, että protonit olivat tämän alueen sisällä. Yksi Ernest Rutherfordin kollegoista, James Chadwick, suoritti ja tutki berylliumin radioaktiivisia reaktioita. Osuessaan berylliumin ytimeen alfahiukkasilla syntyi neutronihiukkanen. Vuonna 1932 James Chadwick ilmoitti kolmannen subatomisen hiukkasen, neutronin, olemassaolosta. Tämän hiukkasen massa on 1 atomimassayksikkö, mutta sillä ei ole varausta. Tämän löydön jälkeen ydintiede ja -tekniikka alkoivat välittömästi.
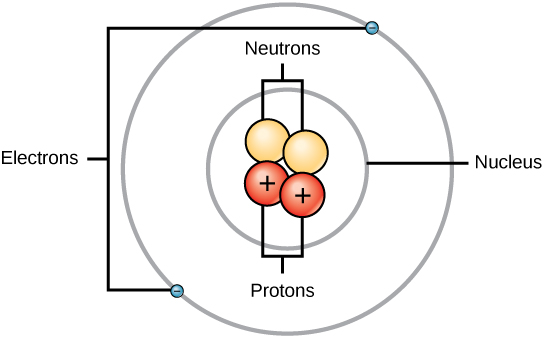
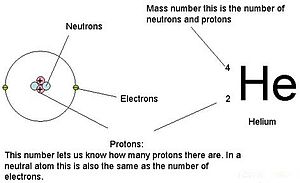
Kolmen subatomisen hiukkasen massat voidaan ilmaista amuina (atomimassayksikköinä) tai grammoina. Yksinkertaisuuden vuoksi käytämme kolmen osaatomin osalta amu-yksikköä. Sekä neutronien että protonien massat ovat kumpikin 1 amu. Elektronin massa on sitä vastoin häviävän pieni, 0,0005 amu. Tämän osaatomin massaa ei esitetä jaksollisessa järjestelmässä näkyvässä desimaalimassassa. Vain protonit ja neutronit vaikuttavat atomin massa-arvoon.
fi:Käyttäjä:Materiaalitieteilijä)
Atomeilla (neutraaleilla lajeilla) elektronien lukumäärä vastaa protonien lukumäärää. Näin ollen kaikkien atomien kokonaisvaraus on nolla. Ioneja (atomit, jotka saavat tai menettävät elektroneja) käsitellään tämän luvun loppuosassa. Atomeja, joiden neutroni- ja massa-arvot poikkeavat taulukosta, kutsutaan isotoopeiksi. Näitä erityisiä lajeja tarkastellaan seuraavassa tekstin osassa.
| Subatominen hiukkanen | Symboli | Relatiivinen varaus | Sijoituspaikka | Amu-massa |
|---|---|---|---|---|
| Protonin | p | +1 | ytimen sisällä | 1 |
| Neutroni | n | 0 | ytimen sisällä | 1 |
| Elektroni | e- | -1 | ytimen ulkopuolella | 0.0005 (~0) |
Esimerkki \(\PageIndex{1}\)
Mikä on totta?
- Ytimessä on protoneja ja elektroneja.
- Elektronin massa sisältyy atomin massaan
- Atomin kohdalla protonien lukumäärä = elektronien lukumäärä.
Ratkaisu
- Väärin, ydin sisältää protonit ja neutronit. Elektronit ovat ytimen ulkopuolella.
- Väärin, elektronit eivät vaikuta atomin massalukuun.
- Tosi, kaikki atomit ovat neutraaleja ja niissä on oltava yhtä monta protonia kuin elektronia.




