6.17: Moniatomiset ionit
Keskustelumme ionisista yhdisteistä rajoittui yksiatomisiin ioneihin. Monimutkaisempia ioneja, jotka sisältävät useita kovalenttisesti toisiinsa sitoutuneita atomeja, mutta joilla on positiivinen tai negatiivinen varaus, esiintyy kuitenkin melko usein kemiassa. Varaus syntyy, koska atomien valenssielektronien kokonaislukumäärä ei pysty tuottamaan vakaata rakennetta. Kun yksi tai useampi elektroni lisätään tai poistetaan, syntyy stabiili rakenne. Tunnettuja esimerkkejä tällaisista moniatomisista ioneista ovat sulfaatti-ioni (SO42-),
sulfaatti-ioni (SO42-),
hydroksidi-ioni (OH-),
hydronium-ioni (H3O+),
ja ammonium-ioni (NH4+).
Atomeja näissä ioneissa yhdistävät kovalenttiset elektronipari-sidokset, ja voimme piirtää Lewisin rakenteet ioneille aivan kuten molekyyleillekin. Ainoa ero on se, että ionin elektronien lukumäärä ei ole täsmälleen tasapainossa ydinvarausten summan kanssa. Joko elektroneja on liikaa, jolloin kyseessä on anioni, tai liian vähän, jolloin kyseessä on kationi.
Tarkastellaan esimerkiksi hydroksidi-ionia (OH-), jonka Lewis-rakenne on
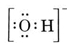
Neutraalissa molekyylissä, jossa on yksi O- ja yksi H-atomi, olisi vain seitsemän elektronia, kuusi O:n ja yksi H:n. Hydroksidi-ionissa on kuitenkin kahdeksan elektronia, eli yksi elektroni enemmän kuin neutraalissa molekyylissä. Hydroksidi-ionilla on siis oltava yksi negatiivinen varaus. Jotta voimme piirtää Lewisin rakenteen tietylle ionille, meidän on ensin määritettävä, kuinka monta valenssielektronia on mukana. Oletetaan, että tarvitaan H3O+:n rakenne. Elektronien kokonaismäärä saadaan laskemalla yhteen kunkin atomin valenssielektronit, 6 + 1 + 1 + 1 + 1 = 9 elektronia. Nyt on vähennettävä 1 elektroni, koska tarkasteltava laji ei ole H3O vaan H3O+. Elektronien kokonaismäärä on siis 9 – 1 = 8. Koska kyseessä on kahdeksikkoelektroni, voimme sijoittaa ne kaikki O-atomin ympärille. Lopullinen rakenne seuraa tällöin hyvin helposti:
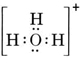
Monimutkaisemmissa tapauksissa on usein hyödyllistä laskea jaettujen elektroniparien lukumäärä ennen Lewisin rakenteen piirtämistä. Tämä pätee erityisesti silloin, kun kyseessä oleva ioni on oksianioni (eli keskusatomia ympäröi useampi O-atomi). Tunnettu oksianioni on karbonaatti-ioni, jonka kaava on CO32-. (Huomaa, että keskusatomi C kirjoitetaan ensin, kuten aiemmin tehtiin molekyylien kohdalla). CO32-:n käytettävissä olevien valenssielektronien kokonaismäärä on
\( 4 \text{(C:lle)} + 3 \ kertaa 6 \text{(O:lle)}. + 2 \text{(-2 varausta varten)} = 24 \)
Meidän on jaettava nämä elektronit neljälle atomille, jolloin jokaisella on oktetti, eli tarvitaan 4 × 8 = 32 elektronia. Tämä tarkoittaa, että 32 – 24 = 8 elektronia on laskettava kahdesti oktettia varten, eli 8 elektronia jaetaan. Näin ollen a-ionissa on neljä elektroniparisidosta. Oletettavasti C-atomi on kaksoissidoksissa yhteen O:sta ja yksisidoksissa kahteen muuhun:
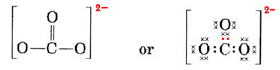
Tässä kaaviossa 4 C-elektronia on esitetty pisteillä, 18 O-elektronia ×:llä ja 2 ylimääräistä elektronia värillisinä pisteinä. Todellisilla elektroneilla ei ole tällaisia merkintöjä; ne ovat kaikki samanlaisia.
Juuri piirrettyä Lewisin rakennetta vastaan on vakava vastaväite. Mistä elektronit tietävät, mikä happiatomi on erotettava ja muodostettava kaksoissidos sen kanssa, koska happigeenejä ei muuten erota toisistaan mikään? Vastaus on, että ne eivät tiedä. CO32-ionin ja joidenkin muiden molekyylien sidosten selittäminen edellyttää Lewisin teorian laajentamista. Jatkamme tätä asiaa tarkemmin, kun käsittelemme resonanssia. Nyt lopetamme esimerkkiin.
Esimerkki \(\PageIndex{1}\) : Lewisin rakenne
Piirrä Lewisin rakenne sulfiitti-ionille, SO32-.
Liuos Turvallisin menetelmä tässä on laskea elektronit. Käytettävissä olevien valenssielektronien kokonaismäärä on
6(S:lle) + 3 × 6(O:lle) + 2(varaukselle) = 26Valenssielektronien muodostamiseen neljälle atomille tarvittaisiin 32 elektronia, joten erotus, 32 – 26 = 6, antaa jaettujen elektronien määrän. Ionissa on siis vain kolme elektroniparisidosta. Keskeisen S-atomin on oltava sidoksissa yhdellä sidoksella jokaiseen O-atomiin.
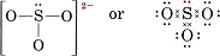
Huomaa, että jokainen S-O-sidos on koordinaattikovalenttinen.
Tekijät
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Minnesotan Rochesterin yliopisto), Tim Wendorff ja Adam Hahn.




