Frontiers in Pharmacology
Introduction
Olantsapiini on yksi yleisimmin käytetyistä toisen sukupolven antipsykooteista (SGA) skitsofrenian, kaksisuuntaisen mielialahäiriön ja psykoottisten oireiden hoitoon. Sen lisäksi, että olantsapiini parantaa psykoosin tärkeimpiä oireita, sillä on suuri hyväksyttävyys, se vähentää kaikenlaista keskeyttämistä ja ehkäisee tulevia relapseja (Leucht ym., 2009). Monet satunnaistetut kliiniset tutkimukset (RCT) ja meta-analyysit ovat viitanneet siihen, että olantsapiini on yksi tehokkaimmista psykoosilääkkeistä skitsofreniapotilailla (Leucht ym., 2013; Huhn ym., 2019).
Olantsapiinin yleisin haittavaikutus on painonnousu (Allison ym., 1999). Olantsapiini aiheuttaa SGA-lääkkeistä eniten painonnousua. Comparison of Atypicals for First Episode (CAFE) -tutkimus osoitti, että 80 % olantsapiinilla hoidetuista potilaista lihoi yli 7 % alkuperäisestä ruumiinpainostaan viikolla 52 (McEvoy ym., 2007). Olantsapiinin lopettamisprosentti painonnousun tai siihen liittyvien aineenvaihdunnallisten vaikutusten vuoksi oli 2-8 kertaa suurempi kuin muiden antipsykoottien lopettamisprosentti Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) -tutkimuksessa (Lieberman ym., 2005). Sen lisäksi, että painonnousu liittyy lääkehoitoon sitoutumisen heikkenemiseen, siihen liittyy myös huomattavaa lääketieteellistä sairastavuutta ja kuolleisuutta. Kun otetaan huomioon skitsofreniapotilaiden korkea lihavuusaste (42 %), olantsapiinin aiheuttaman painonnousun mahdollinen riski olisi arvioitava huolellisesti (Newcomer, 2006). Joissakin satunnaistetuissa kontrolloiduissa tutkimuksissa (RCT-tutkimuksissa) on havaittu, että mielenterveyspotilaat kuolevat jopa 30 vuotta aikaisemmin kuin väestö yleensä (Das-Munshi ym., 2017). Johtava kuolinsyy tässä väestössä on sydänsairaudet. Tärkeä sydänsairauksien ja ennenaikaisen kuoleman riskitekijä näillä potilailla on painonnousu (Fekadu ym., 2015).
Mekanismeja, jotka ovat antipsykoottien aiheuttaman painonnousun ja epäsuotuisten metabolisten vaikutusten taustalla, ei tunneta hyvin (Correll ym., 2011). Olantsapiiniin liittyy kohonnut ruokahalu ja ruoan saanti sekä vähentynyt aktiivisuus tai aineenvaihdunnan säätelyn heikentyminen (Roerig ym., 2005; Henderson ym., 2015). Fountaine ym. raportoivat, että terveillä miehillä olantsapiini lisäsi ruumiinpainoa lisääntyneen ravinnonsaannin kautta ilman näyttöä vähentyneestä aktiivisuudesta tai kulutustasosta (Fountaine ym., 2010). Tämä havainto on sopusoinnussa skitsofreniaa sairastavien nuorten miespotilaiden havaintojen kanssa (Gothelf ym., 2002). Potilaiden painoindeksi nousi merkittävästi lisääntyneen kalorien saannin vuoksi 4 viikon olantsapiinihoidon jälkeen (Gothelf ym., 2002). Nykyinen näyttö ruokahalun ja painonnousun yhteydestä on kuitenkin epäselvä (Poyurovsky ym., 2007; Case ym., 2010). Case ym. raportoivat, että varhaiset ruokahalun muutokset eivät johdonmukaisesti korreloineet kokonaispainon muutokseen neljässä eri tutkimuksessa (Case ym., 2010). Lisäksi yhdessäkään tutkimuksessa ei ole raportoitu ruokahalun lisääntymisen tarkkaa ajankohtaa, verrattu painonnousun nopeutta suhteessa lisääntyneen ruokahalun ajoitukseen tai arvioitu painonnousun ja aineenvaihdunnallisten vaikutusten eroja niiden potilaiden välillä, joiden ruokahalu oli lisääntynyt tai pysynyt ennallaan. Siksi arvioimme ruokahalun lisääntymisen ja olantsapiinin aiheuttamien painonmuutosten ja niihin liittyvien aineenvaihdunnallisten vaikutusten välistä yhteyttä lääkkeettömillä skitsofreniaa sairastavilla ensimmäisen jakson potilailla.
Aineisto ja menetelmät
Osallistujat
Tutkimus suoritettiin Kiinan Central South Universityn toisen Xiangya-sairaalan mielenterveysinstituutissa joulukuun 2016 ja huhtikuun 2019 välisenä aikana. Osallistujat arvioitiin skitsofrenian osalta mielenterveyshäiriöiden diagnostisen ja tilastollisen käsikirjan viidennessä painoksessa (DSM-5) määriteltyjen kriteerien mukaisesti (A.P. Association, 2013). Koska antipsykootti-naiviset/ensimmäisen jakson potilaat näyttävät lihovan enemmän olantsapiinihoidon jälkeen (Correll et al., 2011), otimme tähän tutkimukseen mukaan 18-50-vuotiaat ensimmäisen jakson skitsofreniapotilaat.
Hylkäyskriteereihin kuuluivat (i) kliinisesti poikkeavat löydökset fyysisissä tutkimuksissa, laboratoriokokeissa tai EKG-tuloksissa; (ii) häiriöt, kuten älyllinen kehitysvammaisuus, päihteiden tai alkoholin käyttöhäiriö, muiden erityisten systeemisten sairauksien diagnoosi DSM-5-kriteerien mukaisesti; (iii) sydän- ja verisuonisairaudet ja aineenvaihduntasairaudet, kuten diabetes mellitus, dyslipidemiat ja verenpainetauti; (iv) aiemmat syömishäiriöt; (v) tiukka ruokavalio seulontaa edeltävän kuukauden aikana tai tutkimuksen aikana; ja (vi) raskaus tai imetys.
Interventio
Edelliset tutkimukset ovat viitanneet siihen, että olantsapiinin aiheuttama painonnousu oli nopeinta 12 ensimmäisen hoitoviikon aikana (Correll ym, 2009). Siksi osallistujia hoidettiin olantsapiinilla (15-20 mg/vrk klo 20.00) 12 viikon ajan. Olantsapiinin aloitusannos oli 5 mg/vrk, jonka jälkeen se säädettiin 15-20 mg:aan/vrk ensimmäisellä viikolla.
Assessio
Alkuarviointeihin kuuluivat demografiset tiedot, perusteellinen anamneesi, antropometriset mittaukset (paino ja pituus), ruokahalu, fyysinen tutkimus ja laboratoriotutkimukset. Ruokahalu arvioitiin päivittäin 30 minuuttia ennen lounasta neljällä standardoidulla kysymyksellä: Nälkä, kylläinen olo, ruoan ajattelu ja ylensyönti. Vastaukset arvioitiin asteikolla 0-10, jossa 0 = ”ei lainkaan” ja 10 = ”erittäin”. Ruokahalun lisääntyminen määriteltiin >10 prosentin lisäykseksi lähtötilanteen ruokahalupisteissä. Ruokahalun väheneminen määriteltiin >10 %:n vähennykseksi lähtötason ruokahalupisteissä. Positiivisen ja negatiivisen oireyhtymän asteikkoa (PANSS) käytettiin skitsofreniaoireiden vakavuuden arviointiin. Haittavaikutuksia arvioitiin TESS-asteikolla (Treatment Emergent Symptom Scale). Jokaisella seurantakäynnillä kaikki lähtötilanteen arvioinnit (mukaan lukien lääkärintarkastus, antropometriset mittaukset, ruokahalu ja TESS) toistettiin PANSS:ää lukuun ottamatta. PANSS arvioitiin uudelleen viikolla 12.
Paino ja pituus mitattiin ennen hoitoa ja paastotilassa sen jälkeen, kun osallistujat olivat riisuneet kengät ja kevyet sisävaatteet. Ruokahalu arvioitiin ennen lounasta ja se perustui arvioivan lääkärin arvioon tutkimuspäivänä. Laboratoriotutkimukset, mukaan lukien plasman glukoosi-, maksa- ja munuaistoiminta, arvioitiin entsymaattisilla menetelmillä Boehringer Mannheim/Hitachi 714 -automaattikemianalysaattorilla. Insuliini mitattiin kiinteän faasin entsyymi-immunosorbenttimäärityksellä (ELISA).
Ensisijaiset päätetapahtumat olivat niiden potilaiden prosenttiosuus, joiden ruokahalu oli lisääntynyt, ja aika, joka kului olantsapiinihoidon ja lisääntyneen ruokahalun välillä. Toissijaisia tuloksia olivat muutokset painossa, painoindeksissä (BMI), paastoglukoosissa, paastoinsuliinissa ja insuliiniresistenssi-indeksissä, lipidiprofiileissa, joihin kuuluivat triglyseridit, kolesteroli, suuritiheyksinen lipoproteiini (HDL-C) ja pienitiheyksinen lipoproteiini (LDL-C), sekä PANSS-pisteytyksessä. BMI laskettiin Kiinan lihavuustyöryhmän kriteerien mukaisesti: terveellinen paino (18,5 ≤ BMI <25 kg/m2), ylipaino (25 ≤ BMI ≤ 28 kg/m2) ja lihavuus (BMI > 28 kg/m2). Dyslipidemia määriteltiin kolesteroliksi ≥ 5,18 mmolċl-1, triglyserideiksi ≥ 1,70 mmolċl-1, HDL-C:ksi < 1,04 mmolċl-1 tai LDL-C:ksi ≥ 3,37 mmolċl-1 kiinalaisten dyslipidemiaohjeiden perusteella (Hu, 2017). Mukaan otettiin myös analyysi niiden potilaiden osuudesta, jotka saivat yli 7 % lähtötilanteen ruumiinpainostaan 12 viikon jälkeen, mikä on kliinisesti merkittävän painonnousun raja-arvo (Kanders ym., 1991).
Tilastollinen analyysi
Tilastolliseen analyysiin käytettiin SPSS v25.0 (SPSS v25.0) -pakettia (Statistical Package for Social Sciences, versio 25.0). Jatkuvia muuttujia ja kategorisia muuttujia kuvataan käyttämällä yhteenvetotilastoja (keskiarvot ja keskihajonnat) tai vastaavasti frekvenssejä ja prosenttiosuuksia. Studentin t-testiä ja khiin neliö -analyysejä käytettiin analysoimaan ryhmien välisiä eroja painon, BMI:n, paastoglukoosin ja insuliinin, insuliiniresistenssi-indeksin, triglyseridien, kolesterolin, HDL-C:n ja LDL-C:n muutoksissa lähtötilanteesta kuhunkin ajanhetkeen. Painon, BMI:n, insuliiniresistenssi-indeksin, LDL-C:n ja ruokahalun välistä yhteyttä tutkittiin lineaarisella regressioanalyysillä. P-arvoa (p) < 0,05 pidettiin tilastollisesti merkitsevänä.
Tulokset
Tutkimukseen osallistui yhteensä 33 skitsofreniapotilasta (keski-ikä 23,5 vuotta; vaihteluväli 18-36 vuotta). Naispotilaiden osuus oli suurempi (63,6 %, 21/33). Kaikki potilaat olivat normaalin painoindeksin alueella (keskimääräinen painoindeksi 21,3 ± 1,7 kg/m2). Skitsofrenian keskimääräinen kesto oli 11,2 ± 3,7 (vaihteluväli 5-18) kuukautta. Kaksi naispotilasta keskeytti tutkimuksen neljän viikon jälkeen lisääntyneen ruokahalun vuoksi; loput 31 (93,9 %) osallistujaa suorittivat tutkimuksen loppuun (taulukko 1).
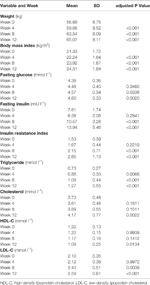
Taulukko 1 Yhteenveto paino- ja aineenvaihduntamittauksista tutkimuksittain.
Syömishalun lisääntyminen olantsapiinihoidon jälkeen
12 viikkoa kestäneen olantsapiinihoidon jälkeen 77,4 %:lla (24/31) potilaista ruokahalu lisääntyi ja 22,6 %:lla (7/31) potilaista ruokahalu pysyi ennallaan. Kuten kuvasta 1 käy ilmi, niillä 24 potilaalla, joiden ruokahalu oli lisääntynyt, ruokahalun lisääntyminen alkoi olantsapiinihoidon ensimmäisten 8 viikon aikana ja kesti hoidon loppuun asti. Keskimääräinen aika olantsapiinihoidon aloittamisesta ruokahalun lisääntymiseen oli 20,3 päivää (SD = 14,4), ja 25,0 %:lla (6/24) ja 70,8 %:lla (17/24) ruokahalu lisääntyi yhden viikon ja neljän viikon kuluessa. Kahden potilaan ruokahalu lisääntyi 3. päivänä olantsapiinihoidon jälkeen. Olantsapiinin aiheuttamassa ruokahalussa ei havaittu merkitsevää eroa eri sukupuolten välillä kaksisuuntaisen ANOVA-analyysin avulla.
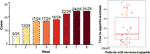
KUVIO 1 Niiden potilaiden lukumäärä, joiden ruokahalu lisääntyi 8 viikon olantsapiinihoitojaksojen aikana.
Kehon painon ja BMI:n muutokset olantsapiinihoidon jälkeen
Olantsapiinihoidon jälkeen havaittiin merkitseviä painon ja BMI:n nousuja (taulukko 1). Keskimääräinen painonnousu oli 7,9 kg 12 viikon olantsapiinihoidon aikana, ja potilaat saivat painonnousua 2,4, 4,0 ja 1,5 kg ensimmäisellä, toisella ja kolmannella 4 viikon jaksolla. Naispotilaat lihoivat todennäköisemmin (P < 0,001), ja keskimääräinen painonnousu oli 9,19 kg tutkimusjakson aikana verrattuna miespotilaiden 5,90 kg:n painonnousuun. Kaikista potilaista 80,6 % (25/31) lisäsi alkuperäistä painoaan yli 7 % ja 61,3 % (19/31) yli 10 % 12 viikon olantsapiinihoidon aikana (lisätaulukko 1). 12 viikon jälkeen 51,6 %:sta (16/31) potilaista tuli ylipainoisia (BMI>25 kg/m2).
Aineenvaihduntahäiriöiden muutokset olantsapiinihoidon jälkeen
Olantsapiinihoidon jälkeen havaittiin 12 viikon aikana merkitseviä nousuja paastoglukoosissa, paastoinsuliinissa, insuliiniresistenssi-indeksissä, triglyseridissä, kolesterolissa ja LDL-C:ssä sekä laskua HDL-C:ssä (taulukko 1). Yhdelläkään tutkimukseen osallistuneella potilaalla ei ollut dyslipidemiaa lähtötilanteessa. Kiinalaisten dyslipidemiaohjeiden perusteella 38,7 %:lla (12/31) potilaista oli dyslipidemia 12 viikon olantsapiinihoidon jälkeen.
Halun lisääntyminen ja olantsapiinin aiheuttama painonnousu
Havaitaksemme lisääntyneen ruokahalun vaikutuksen olantsapiinin aiheuttamaan painonnousuun, jaoimme potilaat kahteen ryhmään (lisääntyneen ruokahalun ryhmään ja muuttumattomana pysyneen ruokahalun ryhmään ) sen perusteella, lisääntyikö ruokahalu 12 viikon olantsapiinihoidon jälkeen.
Muuttumattoman ruokahalun ryhmään verrattuna ruokahalun lisääntymisryhmässä paino ja BMI-arvot kasvoivat merkittävästi 12 viikon olantsapiinihoidon jälkeen (taulukko 2). Kuvassa 2 esitettiin painonnousun ja aineenvaihduntaan liittyvien tulosten vertailu lisääntyneen ja muuttumattoman ruokahalun ryhmien välillä. Yksityiskohtaiset analyysit esitettiin lisätaulukossa 2. Painonnousu kahden ryhmän välillä oli merkitsevä (P = 0,01) käyttämällä kaksisuuntaista ANOVA-analyysiä. Keskimääräinen paino nousi 9,1 kg (SD = 4,1) lisääntyneen ruokahalun ryhmässä ja 3,9 kg (SD = 2,0) muuttumattoman ruokahalun ryhmässä, ja näiden kahden ryhmän välillä oli merkittävä ero 12 viikon olantsapiinihoitojakson aikana. Suurempi osuus potilaista (91,7 %) lisääntyneen ruokahalun ryhmässä sai yli 7 % alkuperäisestä ruumiinpainostaan 12 viikon jälkeen verrattuna potilaisiin ruokahalun pysyvän muuttumattomana -ryhmässä (42,9 %; χ2 = 8,27, df = 1, p = 0,004). Vastaavasti useammat potilaat lisääntyneen ruokahalun ryhmässä (19/24, 79,2 %) saivat yli 10 % alkuperäisestä ruumiinpainostaan 12 viikon jälkeen verrattuna potilaisiin ruokahalun pysyvän muuttumattomana ryhmässä (0,0 %; χ2 = 14,32, df = 1, p < 0,001) (Täydentävät taulukot 3-5). 12 viikon olantsapiinihoidon jälkeen 58,3 %:sta potilaista tuli ylipainoisia ruokahalun lisääntymisen ryhmässä verrattuna 28,6 %:iin potilaista muuttumattoman ruokahalun ryhmässä. Ruokahalun lisääntyminen välitti vahvasti olantsapiinin aiheuttamaa painonnousua välittävän vaikutuksen ollessa 66,2 %.

Taulukko 2 Kuvailevat tilastotietoja lopputulosmittareista lisääntyneen ja muuttumattoman ruokahalun ryhmien välillä lähtötilanteessa sekä viikoilla 4, 8 ja 12.
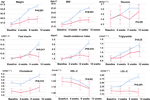
KUVIO 2 Ruumiinpainon, BMI:n, glukoosi- ja rasva-arvojen vertailu lisääntyneen ja muuttumattoman ruokahalun ryhmien välillä. Sininen viiva osoittaa potilaat, joiden ruokahalu oli lisääntynyt; punainen viiva osoittaa potilaat, joiden ruokahalu pysyi muuttumattomana.
Halun lisääntyminen ja olantsapiinin aiheuttamat aineenvaihduntahäiriöt
Insuliinin (p = 0,017), insuliiniresistenssi-indeksin (p = 0,015) ja LDL-C:n (p = 0,001) pitoisuuksissa oli merkitseviä eroavaisuuksia lisääntynyttä ruokahalua ja muuttumatonta ruokahalua edustaneiden ryhmien välillä 1 2 viikon iän jälkeen (kuva 2 ja taulukko 2). Neljän potilaan kolesteroli oli lisääntyneen ruokahalun ryhmässä ≥ 5,18 mmolċl-1, yhdeksän potilaan triglyseridit ≥ 1,70 mmolċl-1, kuuden HDL-C < 1,04ċmmol l-1 ja kolmen LDL-C ≥ 3,37 mmolċl-1 viikolla 12. Yhteensä 13/24 potilaalla lisääntyneen ruokahalun ryhmässä oli dyslipidemia 12 viikon jälkeen, kun taas yhdellekään potilaalle muuttumattoman ruokahalun ryhmässä ei kehittynyt dyslipidemiaa tutkimusjakson aikana (taulukko 3).

Taulukko 3 Kunkin yksittäisen lopputulosmittauksen perusteella määritellyt dyslipidemiat lisääntyneen ja muuttumattoman ruokahalun ryhmissä.
Painonnousun huippu saavutettiin 1 kuukausi ruokahalun lisääntymiskuukauden jälkeen
Nousseen ruokahalun ryhmässä analysoimme kunkin potilaan keskimääräisen painonnousun neljänä ajankohtana: ennen ruokahalun lisääntymiskuukautta (-1M), ruokahalun lisääntymiskuukausi (0M), kuukausi ruokahalun lisääntymiskuukauden jälkeen (+1M) ja kaksi kuukautta ruokahalun lisääntymiskuukauden jälkeen (+2M). Verrattuna -1M:ään painonnousu lisääntyi 0M:ssä, mutta tämä muutos ei ollut merkittävä (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). Painonnousu saavutti huippukasvun +1M:ssä, jolloin 4,3 ± 2.4 kg:n lisäys. Painon kasvu hidastui +2M:n kohdalla (p < 0,001) 1,6 ± 1,5 kg. Painonnousu +2M:ssä hidastui ja vakiintui, eikä merkittäviä eroja havaittu -1M:ään verrattuna (kuva 3 ja lisätaulukko 6).
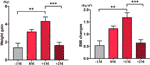
Kuva 3 Keskimääräinen painonnousun nopeus lisääntyneen ruokahalun ryhmässä. Kunkin potilaan keskimääräinen painonnousu kuukaudessa tutkimusjakson aikana analysoitiin neljänä ajankohtana: ennen ruokahalun lisääntymiskuukautta (-1M), ruokahalun lisääntymiskuukautta (0M), 1 kuukausi ruokahalun lisääntymiskuukauden jälkeen (+1M) ja 2 kuukautta ruokahalun lisääntymiskuukauden jälkeen (+2M). ** tarkoittaa P < 0.01, *** tarkoittaa P < 0.001.
Aikaisempi lisääntynyt ruokahalu ennustaa suurempaa painonnousua 1 kuukauden kuluttua ruokahalun lisääntymiskuukaudesta
Vertailimme edelleen niiden osallistujien painonnousunopeutta, joiden ruokahalu oli lisääntynyt 4 viikon kuluessa (A), ja niiden osallistujien painonnousunopeutta, joiden ruokahalu oli lisääntynyt 4 ja 8 viikon välillä (B). 0M:ssä painonnousun nopeudet niiden osallistujien välillä, joiden ruokahalu lisääntyi 4 viikon kuluessa, ja niiden osallistujien välillä, joiden ruokahalu lisääntyi 4 ja 8 viikon välillä, eivät eronneet merkittävästi toisistaan. Osallistujilla, joiden ruokahalu oli lisääntynyt aiemmin, painonnousunopeus oli kuitenkin merkittävästi suurempi +1M:n kohdalla. Nämä tulokset osoittivat, että aiemmin lisääntynyt ruokahalu saattaa johtaa suurempaan painonnousuun seurantajakson aikana (kuva 4). BMI:ssä havaittiin samankaltaisia muutoksia neljän ajankohdan aikana (kuviot 3 ja 4).
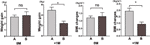
Kuvio 4 Eri kuukausina lisääntynyttä ruokahalua kokeneiden osallistujien painonnousunopeuden vertailu. Vertailimme niiden osallistujien painonnousunopeutta, joiden ruokahalu oli lisääntynyt 4 viikon kuluessa (A), ja niiden osallistujien painonnousunopeutta, joiden ruokahalu oli lisääntynyt 4 ja 8 viikon välisenä aikana (B), lisääntyneen ruokahalun kuukautena (0M) ja 1 kuukausi lisääntyneen ruokahalun kuukautena (+1M). ns, tarkoittaa, että ei merkitsevä, * tarkoittaa, että P < 0,05.
Halukkuus ja aineenvaihduntahäiriöiden muutosten nopeus
Painon, BMI:n, paastoglukoosin, insuliinin, insuliiniresistenssi-indeksin, triglyseridien, kolesterolin, HDL-C:n ja LDL-C:n muutosten yksityiskohtaiset kuvailevat tiedot on esitetty yhteenvetona taulukossa 2. Lisääntyneen ruokahalun sekä glukoosi- ja rasva-aineenvaihdunnan välisen yhteyden tutkimiseksi analysoimme näiden indikaattoreiden muutoksia neljässä eri ajankohtakohteessa lisääntyneen ruokahalun ryhmässä. Glukoosin, triglyseridien, HDL-C:n ja LDL-C:n osalta ei havaittu merkittäviä nopeusmuutoksia missään aikapisteessä. Insuliinin ja insuliiniresistenssi-indeksin nopeuksissa havaittiin merkitseviä lisäyksiä vain +2M:n kohdalla (täydentävä kuva 1 ja täydentävä taulukko 6). Lisävertailut viittasivat siihen, että osallistujilla, joiden ruokahalu oli lisääntynyt 4 viikon kuluessa, insuliinin ja insuliiniresistenssi-indeksin nopeus ei lisääntynyt merkitsevästi 0M:ssä ja +1M:ssä verrattuna osallistujiin, joiden ruokahalu oli lisääntynyt 4-8 viikon välillä (Täydentävä kuva 2).
Halukkuuden ennustaminen olantsapiinin aiheuttamaan painonnousuun ja aineenvaihduntahäiriöihin
Toteutimme lineaarisen regressioanalyysin arvioidaksemme halukkuuden lisääntymisen vaikutusta painonnousuun, veren glukoosiin ja lipidiarvoihin. Kun olimme kontrolloineet tilastollisesti merkittävät muuttujat, kuten sukupuoli, ikä, pituus ja kesto, otimme regressioanalyysiin mukaan painonnousun, BMI:n, paastoglukoosin, insuliinin, insuliiniresistenssi-indeksin, triglyseridit, kolesterolin, HDL-C:n ja LDL-C:n riippuvaisina muuttujina ja ruokahalun riippumattomana muuttujana. Ruokahalun lisääntyminen oli yhteydessä muutoksiin painossa (β = 0,67, p = 0,0003), BMI:ssä (β = 0,63, p = 0,0004), insuliinissa (β = 0,49, p = 0,019), insuliiniresistenssi-indeksissä (β = 0,51, p = 0,0149) ja LDL-C:ssä (β = 0.61, p = 0,0035) (Liitetaulukko 7).
Olantsapiinihoidon jälkeen havaittiin kliinisten oireiden (arvioituna PANSS:llä, p < 0,001) merkittävää paranemista lähtötilanteesta loppupisteeseen. Lisääntyneen ruokahalun ja muuttumattoman ruokahalun ryhmien välillä ei havaittu merkittävää eroa PANSS:ssä (p > 0,05).
Haittavaikutukset
Tutkimuksen loppuun saattaneista 31 potilaasta yhdeksän (29.0 %) potilasta raportoi hypoaktiivisuutta, kahdeksan (25,8 %) potilasta raportoi somnolenssia, neljällä (12,9 %) potilaalla oli epänormaali maksakoe, kaksi (6,5 %) potilasta raportoi akatisiaa, neljällä (12,9 %) potilaalla oli ummetusta, yhdellä (3.2 %) potilaalla oli ripulia, ja kaksi (6,5 %) potilasta tunsi huimausta. 80,6 % (25/31) potilaista lisäsi ruumiinpainoaan yli 7 % tutkimusjakson aikana.
Keskustelu
Tässä prospektiivisessa tutkimuksessa tärkeimmät havainnot osoittivat, että 77,4 %:lla potilaista ruokahalu lisääntyi olantsapiinihoidon jälkeen, ja nämä potilaat, jotka lisäsivät ruokahalua, saivat enemmän painoa kuin ne potilaat, joiden ruokahalu säilyi ennallaan (9,1 kg vs. 3,9 kg). Samoin useammat potilaat lisääntyneen ruokahalun ryhmässä lisäsivät alkuperäistä ruumiinpainoaan yli 7 tai 10 %, mikä viittaa siihen, että lisääntynyt ruokahalu liittyy huomattavaan painonnousuun lääkkeettömillä skitsofreniapotilailla, joita hoidetaan ensimmäisellä skitsofreniajaksolla olantsapiinilla. Lisäksi lineaarinen regressioanalyysi tuki sitä, että ruokahalun lisääntyminen oli vahvasti yhteydessä olantsapiinin aiheuttamaan painonnousuun. Nämä havainnot olivat linjassa aiempien raporttien kanssa (Gothelf ym., 2002; Cope ym., 2005). Murashita ym. (2005) havaitsivat lisääntyneitä ruokahalua stimuloivia greliinitasoja ja kehon rasvaprosenttia skitsofreniapotilailla, joita hoidettiin olantsapiinilla. Satunnaistetun kaksoissokkotutkimuksen tulokset viittasivat siihen, että olantsapiini aiheutti ruokahalua ja ahmimista enemmän kuin klotsapiini (Murashita ym., 2005; Kluge ym., 2007). Samanlaisia tuloksia raportoitiin myös olantsapiinilla hoidetuilla hiirillä (Cope et al., 2005). Olantsapiinin vaikutusta useisiin reseptoripaikkoihin, erityisesti ruokahalua muokkaaviin D2- ja 5H3-reseptoreihin, on sovellettu myös anorexia nervosan ja kemoterapian aiheuttaman pahoinvoinnin ja oksentelun hoidossa (Kluge ym., 2007; Tan ym., 2009; Kafantaris ym., 2011).
Havaitsimme myös, että 70,8 %:lla potilaista ruokahalu lisääntyi ensimmäisten neljän viikon aikana ensimmäisestä olantsapiinihoidostaan, ja ruokahalun lisääntyminen kesti keskimäärin 20,3 päivää. Joillakin potilailla ruokahalu lisääntyi jopa jo kolmantena päivänä olantsapiinihoidon jälkeen. Mielenkiintoista oli, että potilaat, joiden ruokahalu lisääntyi aikaisemmin, lihoivat todennäköisesti enemmän kuin potilaat, joiden ruokahalu lisääntyi myöhemmin, ja painonnousu oli suurimmillaan 1 kuukauden kuluttua ruokahalun lisääntymisestä. Vaikka olantsapiinin aiheuttamassa ruokahalussa ei havaittu merkittävää eroa miesten ja naisten välillä, naispotilaat lihoivat todennäköisemmin (P < 0,001). Siksi ruokahalua olisi pidettävä indikaattorina olantsapiinin aiheuttaman painonnousun ennustamisessa, erityisesti naispotilailla. Kliinisissä tilanteissa lääkäreiden tulisi kiinnittää enemmän huomiota potilaisiin, joiden ruokahalu lisääntyy varhaisessa vaiheessa olantsapiinihoidon jälkeen, ja aloittaa suunnitelma painonnousun ehkäisemiseksi.
Olantsapiinilla hoidetuilla potilailla esiintyi yli 7 %:n lisäystä alkuperäisestä ruumiinpainosta, mikä vastaa aiempia löydöksiä (Gothelf ym., 2002; Wu ym., 2008). Merkittävän painonnousun lisäksi olantsapiinihoitoa saaneiden potilaiden glukoosi- ja rasva-aineenvaihdunta häiriintyi merkittävästi 12 viikon jälkeen, mikä vastaa aiemmin julkaistuja havaintoja skitsofreniapotilailla (Correll ym., 2011). Verrattuna muuttumattoman ruokahalun ryhmän potilaisiin lisääntyneen ruokahalun ryhmässä oli merkittäviä lipidipoikkeavuuksia. Paastoglukoosi ei eronnut merkittävästi näiden kahden ryhmän välillä. Osallistujilla, joiden ruokahalu oli varhaisessa vaiheessa lisääntynyt, ei havaittu lisääntynyttä insuliinin ja insuliiniresistenssi-indeksin nopeutta seuraavina kuukausina ruokahalun lisääntymisen jälkeen. On mahdollista, että glukoosipitoisuudet ovat riippumattomia painonnoususta, sillä ruokahalu ei vaikuttanut glukoosipitoisuuksiin.
Psykoosilääkkeisiin liittyvät haitalliset fyysiset terveysvaikutukset, kuten painonnousu, aineenvaihduntahäiriöt ja niihin liittyvä sairastavuus, on tunnustettu jo pitkään (Wu ym., 2016). Aiemmissa tutkimuksissa on esitetty, että ruokahalu saattaa ennustaa olantsapiinin aiheuttamaa painonnousua ja haitallisia metabolisia vaikutuksia (Gothelf ym., 2002; Poyurovsky ym., 2007; Fountaine ym., 2010). Tietojemme mukaan tämä on ensimmäinen tutkimus, jossa arvioidaan ruokahalun, painonnousun ja aineenvaihduntahäiriöiden välistä yhteyttä olantsapiinihoidon jälkeen lääkkeettömillä skitsofreniapotilailla, jotka sairastavat ensimmäistä vaihetta. Jotkin havainnot antavat meille lisää näyttöä siitä, miten lääkitys valitaan järkevästi kliinisessä työssä, ja antavat enemmän hyötyä olantsapiinin aiheuttaman painonnousun ja aineenvaihduntahäiriöiden ehkäisemiseksi.
Tutkimuksessamme on useita rajoituksia. Ensinnäkin tässä tutkimuksessa ei mitattu ruoan saantia, kuten aterioita ja välipaloja, vaikka kaikille mukana olleille potilaille annettiin sama standardoitu ruokalista. Korkea rasvan ja fruktoosin saanti voi vähentää ruokahalun hallintaa vaikuttamalla keskeiseen ruokahalun säätelyyn. Korkean fruktoosipitoisuuden ruokavaliolla on todellakin haitallisia vaikutuksia keskeiseen ruokahalun signalointiin ja kognitiivisiin toimintoihin (Lowette ym., 2015; Dalvi ym., 2017). Toiseksi emme tutkineet leptiini- ja greliinitasoja tutkimusjakson aikana. Vastaavasti rasvakudoksesta ja mahalaukusta erittyvillä leptiinillä ja greliinillä on ratkaiseva rooli ruoan saannin ja energia-aineenvaihdunnan säätelyssä (Cui ym., 2017). Useissa tutkimuksissa havaittiin lisääntynyt leptiinitaso ja vähentynyt greliinitaso ensimmäisten viikkojen aikana olantsapiinihoidon aloittamisen jälkeen (Basoglu ym., 2010; Stip ym., 2012; Lu ym., 2015). Leptiinitason nousu pysyy vakaana useita viikkoja, mutta greliinitaso nousee pidemmän ajan kuluessa (Sentissi ym., 2008). Jatkotutkimuksissa olisi seurattava leptiinin ja greliinin vasteita ruokahalun lisääntymiseen sekä niiden suhteita metabolisiin parametreihin ja kliinisiin vaikutuksiin. Lisäksi emme seuranneet aktiivisuustasoja tutkimusjakson aikana. Vaikka joissakin tutkimuksissa raportoitiin, että olantsapiini lisäsi ruumiinpainoa pelkästään lisäämällä ruokahalua ja ruuan saantia, eikä lepoenergiankulutuksessa ollut merkittäviä eroja (Gothelf ym., 2002; Fountaine ym., 2010). Useissa tutkimuksissa raportoitiin fyysisen aktiivisuuden vähentyneen olantsapiinilääkityksen myötä (Perez-Cruzado ym., 2018). Tutkimuksessamme 29,0 % potilaista raportoi hypoaktiivisuutta ja 25,8 % potilaista raportoi uneliaisuutta 12 viikon olantsapiinihoitojakson aikana. Hillebrand ym. (2005) havaitsivat, että olantsapiinihoito vähensi fyysistä aktiivisuutta rotilla, jotka altistuivat aktiivisuusperäiselle anoreksiaan. Olantsapiinihoito vähensi myös anoreksia nervosaa sairastavien potilaiden aktiivisuustasoa ilman merkittäviä eroja kehon painossa ja plasman leptiiniarvoissa verrattuna hoitamattomiin potilaisiin. Aiempi tutkimuksemme osoitti, että elämäntapainterventiot, joihin sisältyi psykoedukaatio-, ruokavalio- ja liikuntaohjelmia, voivat vähentää antipsykoottien aiheuttamaa painonnousua (Wu ym., 2008). Lisäksi olisi parempi verrata useampia potilaita samanikäisiin terveisiin kontrolleihin, mikä voi auttaa tulkitsemaan, että olantsapiinin aiheuttama ruokahalun lisääntyminen ja metaboliset muutokset liittyvät erityisesti sen farmakologisiin ominaisuuksiin. Lisätutkimuksissa olisi keskityttävä olantsapiinihoidon jälkeisen ruokahalun lisääntymisen mekanismeihin (Koopmann ym., 2012; Sweeney ym., 2017; Mancuso ym., 2019). Striataalialueiden palkitsemisjärjestelmä saattaa olla yhteydessä antipsykoottien aiheuttamaan painonnousuun (Nielsen ym., 2016). Muuttunut aktiivisuus subgenuaalisella anteriorisella cingulaarisella aivokuorella voi myös osittain olla lisääntyneen ruokahalun taustalla olantsapiinihoidon jälkeen (Pawlowski ym., 2018). Kuvantamistutkimuksia tulisi tehdä, jotta voitaisiin tutkia ruokahaluun liittyvän syvän aivotoiminnan olantsapiinimodulaatiota.
Johtopäätökset
Johtopäätöksenä tutkimuksemme on osoittanut, että ruokahalu liittyy olantsapiinin aiheuttamaan painonnousuun ja dyslipidemiaan lääkkeettömillä skitsofreniapotilailla, joilla on ensimmäinen episodi. Ruokahalun muutosten arviointi on helppo ja käytännöllinen tapa painonnousun ennustamiseen, mikä antaa kliinikoille enemmän aikaa ja vaihtoehtoja interventiostrategioihin. Varhaiset ruokahalun vähentämiseen ja ruuan saannin vähentämiseen tähtäävät ruokavaliokeksinnöt voivat olla avuksi painonhallinnassa skitsofreniapotilailla, joita hoidetaan olantsapiinilla.
Aineiston saatavuutta koskeva lausunto
Tässä tutkimuksessa tuotetut tietokokonaisuudet ovat saatavissa pyynnöstä vastaavalta kirjoittajalta.
Eettinen lausunto
Tämä tutkimus suoritettiin Helsingin julistuksen mukaisesti (G.A.o.t.W.M. Association, 2013), ja sen hyväksyi Central South Universityn toisen Xiangyan sairaalan eettinen komitea. Sen jälkeen, kun osallistujille oli annettu täydellinen kuvaus tutkimuksesta, saatiin tietoinen suostumus ennen tutkimukseen osallistumista.
Author Contributions
JH analysoi ja tulkitsi potilastiedot ja oli merkittävä tekijä käsikirjoituksen kirjoittamisessa. G-RH pääasiassa suunnitteli ja toteutti tutkimuksen. YeY, C-CL, J-MX, Y-JL ja X-JP auttoivat potilaiden rekrytoinnissa, tietojen laadun seurannassa ja hoidon aiheuttamien haittatapahtumien dokumentoinnissa. YiY auttoi käsikirjoituksen tarkistamisessa. J-PZ ohjasi tutkimuksen suunnittelua. RR-W vastasi yleisestä sisällöstä. Kaikki kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen.
Rahoitus
Tätä työtä ovat tukeneet Kiinan kansallisen tiedesäätiön keskeiset R&D-ohjelmahankkeet (apuraha nro 2016YFC1306900) ja Kiinan kansallinen luonnontieteellinen säätiö (apuraha nro 81622018). ja nro 81901401).
Interintäristiriita
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Haluaisimme antaa tunnustusta osallistujien arvokkaasta panoksesta ja yleislääkäreiden tuesta. Haluamme myös kiittää useita anonyymejä arvioijia heidän arvokkaista kommenteistaan ja ehdotuksistaan artikkelin laadun parantamiseksi.
Lisäaineisto
Tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Supplement Kuva 1 | Veren glukoosi- ja lipidimuutosten nopeus lisääntyneen ruokahalun ryhmässä. Kunkin potilaan keskimääräiset muutosarvot kuukausittain tutkimusjakson aikana analysoitiin neljässä aikapisteessä: ennen ruokahalun lisääntymiskuukautta (-1M), ruokahalun lisääntymiskuukausi (0M), 1 kuukausi ruokahalun lisääntymiskuukauden jälkeen (+1M) ja 2 kuukautta ruokahalun lisääntymiskuukauden jälkeen (+2M).
Lisäkuvio 2 | Lisääntynyttä ruokahalua sairastaneiden osallistujien insuliinin ja insuliiniresistenssi-indeksin muutosten muutosnopeuksien vertailu eri kuukausina. Vertailimme niiden osallistujien, joiden ruokahalu lisääntyi 4 viikon kuluessa (A), ja niiden osallistujien, joiden ruokahalu lisääntyi 4-8 viikon välisenä aikana (B), ruokahalun lisääntymiskuukauden (0M) ja 1 kuukauden kuluttua ruokahalun lisääntymiskuukaudesta (+1M), nopeutta.
Täydentävä taulukko 1 | Niiden potilaiden lukumäärä, joiden alkuperäinen ruumiinpaino oli lisääntynyt yli 7 % tai 10 % viikoilla 4, 8 ja 12.
Täydentävä taulukko 2 | Niiden potilaiden lukumäärä, joiden alkuperäinen ruumiinpaino oli lisääntynyt yli 7 % tai 10 % viikoilla 4, 8 ja 12 potilailla, joiden ruokahalu oli lisääntynyt.
Täydentävä taulukko 3 | Niiden potilaiden lukumäärä, joiden alkuperäinen ruumiinpaino oli lisääntynyt yli 7 % tai 10 % viikoilla 4, 8 ja 12 potilailla, joiden ruokahalu oli pysynyt ennallaan.
Täydentävä taulukko 4 | 7 % tai 10 %:n painonnousun saavuttaneiden potilaiden lukumäärän vertailu potilaiden, joiden ruokahalu oli lisääntynyt, ja potilaiden, joiden ruokahalu oli pysynyt ennallaan, välillä viikoilla 4, 8 ja 12.
Täydennystaulukko 5 | Analyysi keskimääräisen painonnousun, glukoosin ja lipidimuutosten nopeudesta ruokahalua lisänneessä ryhmässä neljänä ajankohtana: ennen ruokahalun lisääntymiskuukautta (-1M), ruokahalun lisääntymiskuukausi (0M), 1 kuukausi ruokahalun lisääntymiskuukauden jälkeen (+1M) ja 2 kuukautta ruokahalun lisääntymiskuukauden jälkeen (+2M). ns tarkoittaa ei merkitsevää, * tarkoittaa p-arvoa < 0,05, ** tarkoittaa p-arvoa < 0,01, *** tarkoittaa p-arvoa < 0,001.
Täydennysosa Taulukko 6 | Estimaatit ruokahalun vaikutuksista painonnousuun ja aineenvaihduntaan liittyviin lopputulosmittareihin yleisestä lineaarisesta sekamallista iän, sairauden keston ja sukupuolen kontrolloinnin yhteydessä.
Täydennystaulukko 7-1 | Painon, BMI:n, insuliinin, IRI:n ja LDL-C:n muutokset potilaskohtaisesti hoitojakson aikana eri ryhmissä.
Täydennystaulukko 7-2 | Arviot ruokahalun vaikutuksista painonnousuun ja aineenvaihduntaan liittyviin lopputulosmittareihin.
Lyhenteet
SGA:t, toisen sukupolven antipsykootit; RCT, satunnaistettu kliininen tutkimus; CAFÉ, The Comparison of Atypicals for First Episode (Atyyppisten lääkkeiden vertailu ensimmäisen jakson hoidossa); CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness (Kliiniset antipsykoottiset tutkimukset interventioiden vaikuttavuuden arvioinnissa); DSM-5, Mielenterveydenhäiriöiden diagnostiikka- ja tilastokäsikirjan viides painos;
Allison, D. B.., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsykoottien aiheuttama painonnousu: kattava tutkimussynteesi. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Mielenterveyshäiriöiden diagnostinen ja tilastollinen käsikirja (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B. , Ates, A. M., Algul, A., et al. (2010). greliinin, kolekystokiniinin, visfatiinin, leptiini- ja agoutiiniin liittyvien proteiinien tasot 6-viikkoisen olantsapiinihoidon aikana psykoosia sairastavilla ensimmäisen jakson miespotilailla. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). Ruokahalun mahdollinen merkitys painonmuutosten ennustamisessa olantsapiinihoidon aikana. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsykoottisten lääkkeiden aiheuttama painonnousu: eläinmallin kehittäminen. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Toisen sukupolven antipsykoottisten lääkkeiden kardiometabolinen riski lasten ja nuorten ensikäytön aikana. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Antipsykoottiset lääkkeet ja lihavuus. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). Leptiini- ja greliiniresistenssin solu- ja molekulaariset perusteet liikalihavuudessa. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Korkea rasva aiheuttaa akuuttia ja kroonista tulehdusta hypotalamuksessa: runsasrasvaisen ruokavalion, palmitaatin ja TNF-alfa vaikutus ruokahalua sääteleviin NPY-neuroneihin. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnisyys ja ylikuolleisuus vakavissa mielisairauksissa: kohorttitutkimus. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Ylimääräinen kuolleisuus vakavissa mielisairauksissa: 10-vuotinen väestöpohjainen kohorttitutkimus Etiopian maaseudulla. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Lisääntynyt ruoan saanti ja energiankulutus olantsapiinin antamisen jälkeen terveille miehille. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). Maailman lääkäriliiton Helsingin julistus: eettiset periaatteet lääketieteellisessä tutkimuksessa, jossa on mukana ihmisiä. Painonnousu, joka liittyy lisääntyneeseen ruoan saantiin ja vähäiseen tavanomaiseen aktiivisuuteen olantsapiinilla hoidetuilla nuorilla skitsofreniaa sairastavilla miespotilailla. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Suurentuneen kardiometabolisen riskin patofysiologiset mekanismit skitsofreniaa ja muita vakavia mielenterveyssairauksia sairastavilla henkilöillä. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olantsapiini vähentää fyysistä aktiivisuutta rotilla, jotka altistuvat aktiivisuuteen perustuvalle anoreksiaan: mahdolliset vaikutukset anorexia nervosan hoitoon? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Uudet ohjeet ja todisteet dyslipidemian ja ateroskleroottisten sydän- ja verisuonitautien ehkäisystä ja hoidosta Kiinassa. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). 32 suun kautta otettavan psykoosilääkkeen vertaileva teho ja siedettävyys monioireista skitsofreniaa sairastavien aikuisten akuuttihoidossa: systemaattinen katsaus ja verkostometa-analyysi. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Plasebokontrolloitu pilottitutkimus täydentävästä olantsapiinista nuorille, joilla on anoreksia nervosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Lihavuuden tutkimusmenetelmät. Conn ”s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Klotsapiini ja olantsapiini liittyvät ruoan himoon ja ahmimiseen: tuloksia satunnaistetusta kaksoissokkotutkimuksesta. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., ym. et al (2012). Appetitiivisen peptidin asetyloidun greliinin yhteys alkoholin himoon varhaisessa vaiheessa pidättäytyvillä alkoholiriippuvaisilla henkilöillä. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Toisen sukupolven vs. ensimmäisen sukupolven antipsykoottiset lääkkeet skitsofrenian hoidossa: meta-analyysi. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). 15 antipsykoottisen lääkkeen vertaileva teho ja siedettävyys skitsofreniassa: monihoitoinen meta-analyysi. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Psykoosilääkkeiden tehokkuus kroonista skitsofreniaa sairastavilla potilailla. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Korkean fruktoosipitoisuuden ruokavalion vaikutukset keskeiseen ruokahalun signalointiin ja kognitiiviseen toimintaan. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Olantsapiinin ja klotsapiinin erilaiset vaikutukset plasman adiposytokiinien ja kokonaisgreliinin tasoihin. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Ruokahalua säätelevien hormonien muutokset ruoan saannin jälkeen liittyvät muutoksiin raportoidussa ruokahalussa ja hedonisen syömisen mittarissa tytöillä ja nuorilla naisilla, joilla on Anorexia Nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Olantsapiinin, ketiapiinin ja risperidonin teho ja siedettävyys varhaisen psykoosin hoidossa: satunnaistettu, kaksoissokkoutettu 52 viikon vertailu. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olantsapiini lisää plasman greliinitasoa skitsofreniapotilailla. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Kaksisuuntaista mielialahäiriötä ja skitsofreniaa sairastavien potilaiden lääketieteellinen riski. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Striatal-palkitsemisaktiivisuus ja antipsykoottisiin lääkkeisiin liittyvä painonmuutos skitsofreniapotilailla, jotka ovat alkuhoidossa. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Olantsapiinin jälkeen lisääntyneen ruokahalun mekanismin tutkiminen sLORETA:lla unen aikana. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Lääkitys ja fyysinen aktiivisuus ja fyysinen kunto vakavissa mielenterveysongelmissa. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Reboksetiinin ruokahalua ja painonnousua heikentävä vaikutus olantsapiinilla hoidettujen skitsofreniapotilaiden ruokahaluun ja painonnousuun: kaksoissokkoutettu lumekontrolloitu tutkimus. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, J. J., et al. (2005). Olantsapiinin ja risperidonin ja lumelääkkeen vaikutusten vertailu syömiskäyttäytymiseen. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptiini- ja greliinitasot skitsofreniapotilailla eri psykoosilääkehoitojen aikana: katsaus. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Ruokahalua koskevien tietojen käsittelyyn liittyvät hermostolliset muutokset skitsofreniapotilailla 16 viikon olantsapiinihoidon jälkeen. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Mediaalisen septin glutamatergisten neuronien ruokahalua tukahduttava rooli. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Olantsapiinin kliininen tutkimus kemoterapian aiheuttaman pahoinvoinnin ja oksentelun ehkäisemiseksi. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Elämäntapainterventio ja metformiini antipsykoottien aiheuttaman painonnousun hoidossa: satunnaistettu kontrolloitu tutkimus. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Antipsykoottien aiheuttaman dyslipidemian metformiinihoito: kahden satunnaistetun, lumekontrolloidun tutkimuksen analyysi. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar
.




