Kemia
Liuoksen muodostuminen on esimerkki spontaanista prosessista eli prosessista, joka tapahtuu määrätyissä olosuhteissa ilman, että tarvitaan energiaa jostain ulkoisesta lähteestä. Joskus sekoitamme seosta nopeuttaaksemme liukenemisprosessia, mutta tämä ei ole välttämätöntä; homogeeninen liuos muodostuisi, jos odottaisimme tarpeeksi kauan. Spontaanisuus on ratkaisevan tärkeää kemiallisen termodynamiikan opiskelun kannalta, ja sitä käsitellään perusteellisemmin tämän tekstin myöhemmässä luvussa. Tässä luvussa riittää, että tarkastellaan kahta kriteeriä, jotka suosivat liuoksen spontaania muodostumista, mutta eivät takaa sitä:
- systeemin sisäisen energian väheneminen (eksoterminen muutos, kuten edellisessä lämpökemiaa käsittelevässä luvussa käsiteltiin)
- systeemin epäjärjestyksen lisääntyminen (mikä osoittaa systeemin entropian lisääntymistä, kuten myöhemmässä termodynamiikkaa käsittelevässä luvussa opitaan)
Liukenemisen yhteydessä tapahtuu usein, mutta ei aina, sisäisen energian muutos lämpöä absorboivana tai kehittyvänä. Liuoksen muodostuessa seuraa aina epäjärjestyksen lisääntyminen.
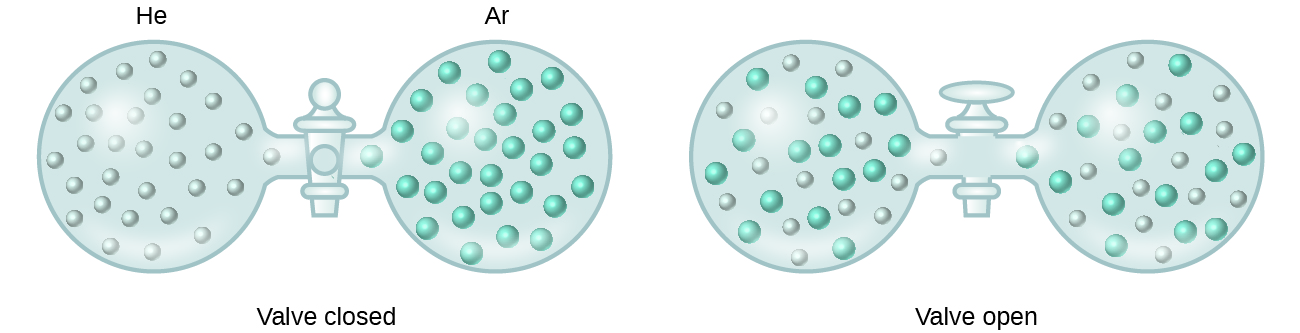
Kun liuenneessa liuoksessa olevien liuenneen aineen ja liuottimen lajien välisten molekyylien välisten vetovoimien voimakkuudet eivät eroa toisistaan erotetuissa komponenteissa esiintyvistä voimista, liuos muodostuu ilman siihen liittyvää energiamuutosta. Tällaista liuosta kutsutaan ideaaliliuokseksi. Ideaalikaasujen seos (tai heliumin ja argonin kaltaiset kaasut, jotka lähestyvät suuresti ideaalista käyttäytymistä) on esimerkki ideaaliliuoksesta, koska näitä kaasuja muodostavilla entiteeteillä ei ole merkittäviä molekyylien välisiä vetovoimia.
Kun heliumia ja argonia sisältäviä säiliöitä liitetään toisiinsa, kaasut sekoittuvat spontaanisti diffuusion ansiosta ja muodostavat liuoksen (kuva 2). Tämän liuoksen muodostumiseen liittyy selvästi epäjärjestyksen lisääntyminen, sillä helium- ja argonatomit valtaavat kaksi kertaa suuremman tilavuuden kuin kumpikin ennen sekoittumista.
Ideaalisia liuoksia voi muodostua myös rakenteellisesti samankaltaisten nesteiden sekoittuessa. Esimerkiksi alkoholien metanoli (CH3OH) ja etanoli (C2H5OH) seokset muodostavat ideaaliliuoksia, samoin hiilivetyjen pentaanin, C5H12, ja heksaanin, C6H14, seokset. Metanolin ja etanolin tai pentaanin ja heksaanin sijoittaminen kuvassa 2 esitettyihin polttimoihin johtaa samaan diffuusioon ja sitä seuraavaan näiden nesteiden sekoittumiseen kuin He- ja Ar-kaasujen kohdalla (vaikkakin paljon hitaammalla nopeudella), jolloin saadaan liuoksia, joiden energia ei muutu merkittävästi. Toisin kuin kaasujen seoksessa, näiden neste-neste-liuosten komponenttien välillä on kuitenkin molekyylien välisiä vetovoimia. Mutta koska kahden sekoitettavan aineen molekyylit ovat rakenteellisesti hyvin samankaltaisia, molekyylien väliset vetovoimat samankaltaisten ja epäsovinnaisten molekyylien välillä ovat olennaisesti samat, eikä liukenemisprosessi näin ollen aiheuta merkittävää energian lisääntymistä tai vähenemistä. Nämä esimerkit havainnollistavat, miten pelkkä diffuusio voi olla liikkeellepaneva voima, jota tarvitaan liuoksen spontaanin muodostumisen aikaansaamiseksi. Joissakin tapauksissa liuenneen aineen ja liuotinlajin välisten molekyylien välisten vetovoimien suhteelliset suuruudet voivat kuitenkin estää liukenemisen.
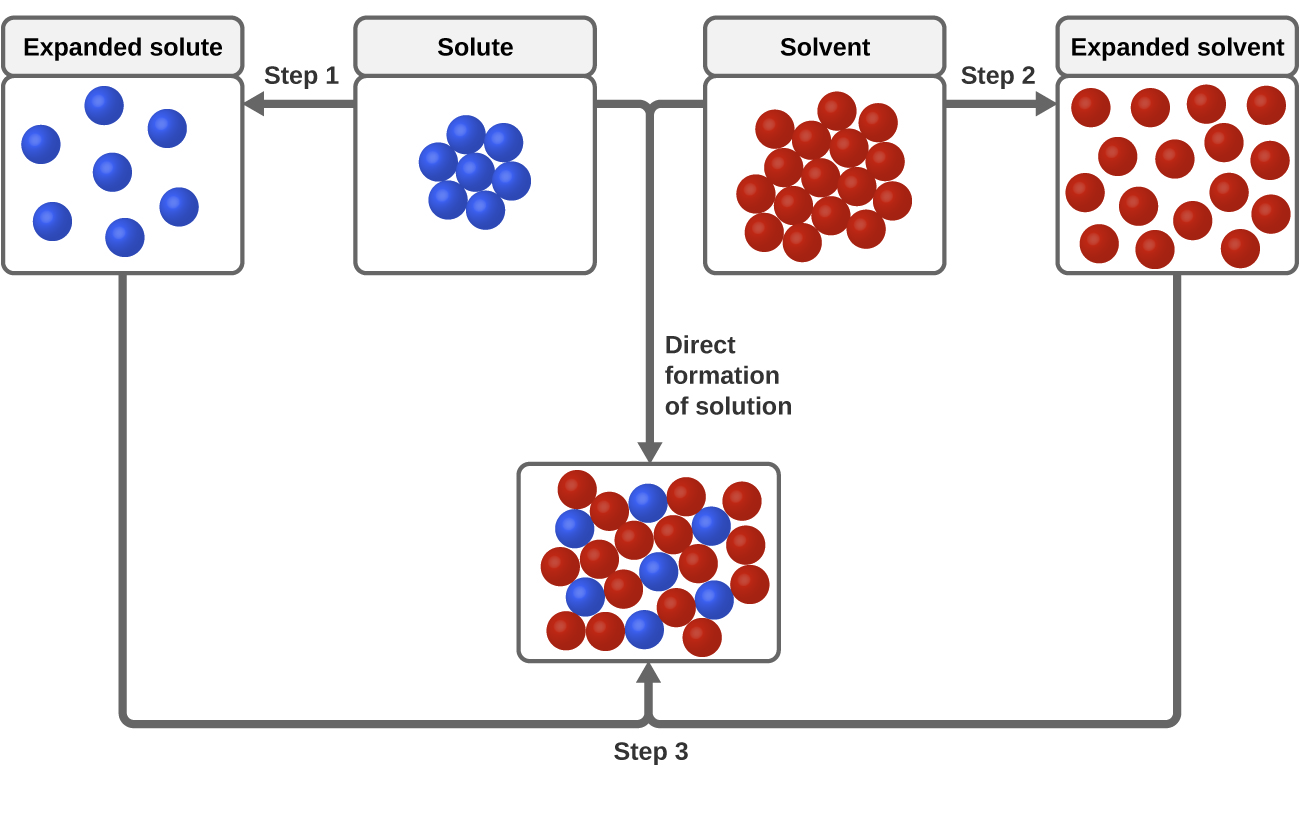
Liukenemisprosessin kannalta merkityksellisiä ovat kolmenlaiset molekyylien väliset vetovoimat: liuos-liuos, liuotin-liuotin ja liuos-liuotin. Kuten kuvassa 3 on havainnollistettu, liuoksen muodostumista voidaan pitää vaiheittaisena prosessina, jossa energiaa kuluu liuoksen ja liuottimen välisen vetovoiman sekä liuottimen ja liuottimen välisen vetovoiman voittamiseen (endotermiset prosessit) ja vapautuu liuoksen ja liuottimen välisen vetovoiman vakiintuessa (eksoterminen prosessi, josta käytetään nimitystä solvaatio). Näihin vaiheittaisiin prosesseihin liittyvien energiamuutosten suhteelliset suuruudet määräävät, vapautuuko vai imeytyykö liukenemisprosessista energiaa. Joissakin tapauksissa liuoksia ei muodostu, koska liuenneen aineen ja liuottimen lajien erottamiseen tarvittava energia on niin paljon suurempi kuin solvatoitumisen vapauttama energia.
Esimerkiksi ruokaöljyt ja vesi eivät sekoitu huomattavassa määrin niin, että niistä syntyisi liuoksia (kuva 4). Vetysidos on nestemäisessä vedessä vallitseva molekyylien välinen vetovoima; ruokaöljyjen poolittomat hiilivetyjen molekyylit eivät kykene vetysidoksiin, vaan ne pysyvät yhdessä dispersiovoimien avulla. Öljyn ja veden välisen liuoksen muodostaminen edellyttäisi veden erittäin voimakkaan vetysidoksen sekä suhteellisen suurten öljymolekyylien välisten huomattavan voimakkaiden dispersiovoimien voittamista. Ja koska polaarisilla vesimolekyyleillä ja poolittomilla öljymolekyyleillä ei olisi kovin voimakasta molekyylien välistä vetovoimaa, liukenemisen seurauksena vapautuisi hyvin vähän energiaa.

Toisaalta etanolin ja veden seos sekoittuu missä tahansa suhteessa ja tuottaa liuoksen. Tällöin molemmat aineet kykenevät vetysidoksiin, joten liukenemisprosessi on riittävän eksoterminen kompensoimaan liuenneen aineen ja liuottimen molekyylien endotermiset erotukset.
Kuten tämän moduulin alussa todettiin, eksotermiset liukenemisprosessit suosivat spontaania liuoksenmuodostusta, mutta eivät takaa sitä. Vaikka monet liukenevat yhdisteet todellakin liukenevat lämmön vapautuessa, jotkut liukenevat endotermisesti. Ammoniumnitraatti (NH4NO3) on yksi tällainen esimerkki, ja sitä käytetään kuvassa 5 esitetyn kaltaisten vammojen hoitoon tarkoitettujen pikakylmäpakkausten valmistukseen. Ohutseinäinen muovipussi, jossa on vettä, on suljettu suurempaan pussiin, jossa on kiinteää NH4NO3:a. Kun pienempi pussi rikotaan, muodostuu NH4NO3-liuos, joka imee lämpöä ympäristöstä (loukkaantuneelta alueelta, johon pakkausta käytetään) ja antaa kylmän pakkauksen, joka vähentää turvotusta. Tämän kaltaiset endotermiset liukenemiset vaativat suuremman energiapanoksen liuenneiden lajien erottamiseen kuin mitä saadaan takaisin, kun liuenneet aineet liukenevat, mutta ne ovat kuitenkin spontaaneja liuoksen muodostumiseen liittyvän epäjärjestyksen lisääntymisen vuoksi.


Katso tämä lyhyt video, joka havainnollistaa endotermisiä ja eksotermisiä liukenemisprosesseja.
Keskeiset käsitteet ja yhteenveto
Liuos muodostuu, kun kaksi tai useampia aineita yhdistyy fysikaalisesti siten, että tuloksena on molekyylitasoltaan homogeeninen seos. Liuotin on väkevin komponentti ja määrää liuoksen fysikaalisen tilan. Liuenneet aineet ovat muita komponentteja, joiden pitoisuudet ovat tyypillisesti pienemmät kuin liuottimen pitoisuudet. Liuokset voivat muodostua endotermisesti tai eksotermisesti riippuen liuenneen aineen ja liuottimen molekyylien välisten vetovoimien suhteellisesta suuruudesta. Ihanteelliset liuokset muodostuvat ilman huomattavaa energiamuutosta.
Kemia Luvun lopun harjoitukset
- Miten liuokset eroavat yhdisteistä? Muista seoksista?
- Mitä liuosten tärkeimmistä ominaisuuksista näemme kuvassa 1 esitetyissä K2Cr2O7-liuoksissa?
- Kun KNO3 liuotetaan veteen, syntyvä liuos on huomattavasti kylmempi kuin vesi oli alun perin.
(a) Onko KNO3:n liukeneminen endoterminen vai eksoterminen prosessi?
(b) Millaisia johtopäätöksiä voitte vetää prosessissa esiintyvistä molekyylien välisistä vetovoimatekijöistä?
(c) Onko syntyvä liuos ideaaliliuos?
- Anna esimerkki kustakin seuraavasta liuostyypistä:
(a) kaasu nesteessä
(b) kaasu kaasussa
(c) kiinteä aine kiinteässä aineessa
- Esittele tärkeimpiä molekyylien välisten vetovoimatekijöiden tyyppejä jokaisessa seuraavassa liuostyypissä:
(a) Kuvan 1 mukainen liuos.
(b) NO(l) CO(l)
(c) Cl2(g) Br2(l)
(d) HCl(aq) bentseenissä C6H6(l)
(e) Metanoli CH3OH(l) H2O(l)
.
- Arvioi, liukenisiko kukin seuraavista aineista paremmin veteen (polaarinen liuotin) vai hiilivetyyn, kuten heptaaniin (C7H16, pooliton liuotin):
(a) kasviöljy (pooliton)
(b) isopropyylialkoholi (polaarinen)
(c) kaliumbromidi (ioninen)
- Joidenkin liuosten muodostuessa vapautuu lämpöä; toisten liuosten muodostuessa lämpöä absorboituu. Anna molekyylinen selitys näiden kahden spontaanin prosessityypin väliselle erolle.
- Palladiumin vetyliuoksia voi muodostua altistamalla Pd-metalli H2-kaasulle. Vedyn pitoisuus palladiumissa riippuu käytetyn H2-kaasun paineesta, mutta monimutkaisemmalla tavalla kuin mitä Henryn laki voi kuvata. Tietyissä olosuhteissa 0,94 g vetykaasua liukenee 215 g:aan palladiummetallia.
(a) Määritä tämän liuoksen molaarisuus (liuoksen tiheys = 1,8 g/cm3).
(b) Määritä tämän liuoksen molaliteetti (liuoksen tiheys = 1,8 g/cm3).
(c) Määritä vetyatomien massaprosentti tässä liuoksessa (liuoksen tiheys = 1,8 g/cm3).




