KEMIA 101 – Elektrolyytit
YLEISET KEMIAN TEEMAT
Elektrolyytit
Ionisten yhdisteiden dissosiaatio vedessä johtaa liikkuvien vesipitoisten ionilajien muodostumiseen.Kemialliset yhtälöt liukenemiseen ja dissosiaatioon vedessä. Vahvat ja heikot elektrolyytit.
Elektrolyytit (musiikillinen säestys tähän aiheeseen) ovat aineita, jotka muodostavat ionilajeja vesiliuoksessa. Varauksenkuljettajien olemassaolo liuoksessa voidaan osoittaa yksinkertaisella kokeella. Vesipitoisten väliaineiden johtavuutta voidaan havainnoida käyttämällä liuokseen upotettua, jännitelähteeseen kytkettyä elektrodiparia. Tällöin liuoksen johtama virta voidaan helposti mitata, ja hehkulamppua voidaan käyttää liuoksen johtavuuden visuaalisena indikaattorina.
Kun tämä koe tehdään puhtaalla vedellä, hehkulamppu ei hehku lainkaan. Vesi itsessään ei johda sähköä helposti; se on esimerkki molekulaarisesta aineesta, joka on epäelektrolyytti. Tämä pätee myös moniin muihin molekyylisiin aineisiin. Esimerkiksi pöytäsokeri (sakkaroosi, C12H22O11) – liukenee melko hyvin veteen, mutta sokeriliuos ei ilmeisesti johda sähköä paremmin kuin pelkkä vesi. Toisaalta, kun suoritamme kokeen vapaasti liukenevalla ionisella yhdisteellä, kuten natriumkloridilla, hehkulamppu hehkuu kirkkaasti.
Kuvaamme, mitä näissä molekyylisen ja ionisen yhdisteen liukenemisen vastakkaisissa tapauksissa mielestämme tapahtuu, kirjoittamalla seuraavat kemialliset yhtälöt:
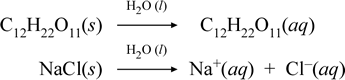
Yllä oleva ensimmäinen yhtälö kuvaa ei-sähköisen yhdisteen, molekyylisen yhdisteen, sakkaroosin, liukenemista. Toinen yhtälö kuvaa ionisen yhdisteen, natriumkloridin, liukenemista.Keskeinen ero näiden kahden kemiallisen yhtälön välillä tässä tapauksessa on se, että jälkimmäisessä muodostuu tuotteina vesipitoisia ionisia lajeja. Ionit voivat vapaasti diffundoitua yksitellen homogeenisessa seoksessa, ja kun jännite kytketään, ionit liikkuvat elektrodien välisen sähköpotentiaalienergiaeron mukaisesti ja kuljettavat siten sähkövirtaa. Huomaa, että vettä ei ole esitetty näiden yhtälöiden reaktiopuolella, vaan se on esitetty nuolen yläpuolella, mikä osoittaa, että vesi määrittää ympäristön, jossa liukenemisprosessi tapahtuu. Veden superstoikiometrinen asema tässä symboliikassa voidaan lukea niin, että liukenemisprosessi tapahtuu veden toimiessa liuottimena. Emme kirjoita vettä reagoivaksi aineeksi vesiliuoksen muodostumisessa yksinkertaisen liuotusprosessin avulla. On monia tapauksia, joissa aine reagoi veden kanssa, kun se sekoittuu veteen ja liukenee siihen. Tämä liuenneen aineen reaktio vesiliuoksessa synnyttää kemiallisesti erillisiä tuotteita. Tällaisissa tapauksissa vesi voidaan nimenomaisesti esittää kemiallisessa yhtälössä reagoivana lajina.
Vahvat ja heikot elektrolyytit
On käynyt ilmi, että kun liukeneva ioniyhdiste, kuten natriumkloridi, liukenee veteen muodostaen vesiliuoksen, joka koostuu liuenneista ioneista, kemiallisessa yhtälössä käytetty oikealle suuntautuva nuoli on perusteltua sikäli, että (niin kauan kuin liukoisuusrajaan ei ole vielä päästy) liuottimena olleeseen veteen lisättävä kiintoaineena oleva kiinteä natriumkloridi dissosioituu täysin. Toisin sanoen NaCl(s) muuntuu käytännössä 100-prosenttisesti Na+(aq):ksi ja Cl-(aq):ksi. Tämän seurauksena johtokykykokeessamme natriumkloridiliuos on hyvin johtava ionien runsauden vuoksi, ja hehkulamppu hehkuu kirkkaasti. Tällaisessa tapauksessa sanomme, että natriumkloridi on vahva elektrolyytti.
Tarkastellaan sitä vastoin molekulaarista ainetta etikkahappo, HC2H3O2.Kun etikkahappo liuotetaan veteen, se muodostaa dissosioitumattoman, liuenneen molekyylilajin, jota symbolisoidaan HC2H3O2(aq):ksi, samaan tapaan kuin sakkaroosin tapauksessa edellä. Kun suoritamme johtavuuskokeen etikkahappoliuoksella, havaitsemme kuitenkin, että hehkulamppu hehkuu, vaikkakin melko heikosti verrattuna natriumkloridiliuoksessa havaittuun kirkkauteen. Tässä tapauksessa etikkahaposta on ainakin osittain muodostunut ioneja veteen. Tätä prosessia kuvaavan kemiallisen yhtälön on osoitettava ionien muodostuminen. Kohtuullinen ehdotus tällaiseksi yhtälöksi olisi:
![]()
Kaksi asiaa on tärkeää huomata tässä yhteydessä. Ensinnäkin kyseessä on tapaus, jossa otamme veden mukaan reagoivana aineena. Kaksi molekulaarista ainetta, vesi ja etikkahappo, reagoivat muodostaen moniatomiset ionit hydronium ja asetaatti. Tätä kuvaava yhtälö on ioniyhtälö. Toinen piirre, josta on syytä keskustella tarkemmin, on oikealle osoittavan nuolen korvaaminen kaksoissymbolilla, joka tarkoittaa kemiallista tasapainoa, ja tässä tapauksessa reaktion tasapainotilanne suosii reagoivia osapuolia, mikä tarkoittaa, että etikkahapon vesiliuoksessa suurin osa etikkahaposta pysyy etikkahappomolekyyleinä ja vain pieni osa on luovuttanut H+ -yhdisteen vedelle muodostaen ioneja. Syntyneiden ionien pieni määrä selittää, miksi etikkahappoliuos ei johda sähköä yhtä hyvin kuin natriumkloridiliuos, jolloin johtavuusilmaisimen hehkulamppu valaistuu vain heikosti. Siksi erotamme toisistaan vahvat elektrolyytit, kuten natriumkloridi, ja etikkahapon, joka on esimerkki heikosta elektrolyytistä.
Kuten nimi etikkahappo kertoo, tämä aine on myös happo sekä heikko elektrolyytti. Näin ollen luokittelemme etikkahapon heikoksi hapoksi. Ensimmäinen (ja vähiten yleinen) määritelmämme hapolle on aine, joka muodostaa vedessä hydroniumionia, mikä on juuri se, mitä yllä oleva ioniyhtälömme osoittaa, kun otetaan huomioon, että heikko happo muodostaa suhteellisen pieniä määriä hydroniumionia.
Kemistit pitävät kovasti lyhenteistä, ja tärkeä lyhenne hydroniumionille on H+(aq), ja sitä käytetään yleisesti. Tämä näkyy edellä olevan yhtälön lyhennetyssä versiossa, joka on esitetty juuri alla. Selvyyden vuoksi todettakoon, että H+ itsessään olisi vain eristetty protoni (1H:lle); siksi on myös tärkeää huomata, että tällaista lajia ei ole vesiliuoksessa.
Lisäksi nuolet on tehty eri pituisiksi osoittamaan reagoivaa ainetta suosivaa tasapainoa, jossa ioneja on paljon vähemmän kuin etikkahappomolekyylejä.
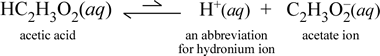
Asettamalla hydronium H+(aq):ksi, etikkahapon ioniyhtälö vedessä on muodollisesti tasapainossa ilman, että siihen sisällytetään vesimolekyyliä reagoivana aineena, mikä on implisiittisesti mukana yllä olevassa yhtälössä.
Ammonia: Esimerkki heikosta elektrolyytistä, joka on heikko emäs
Etikkahappo, kuten juuri näimme, on molekyyliyhdiste, joka on heikko happo ja elektrolyytti. Ammoniakki, NH3, toinen yksinkertainen molekyyliyhdiste, reagoi myös vähäisessä määrin veden kanssa muodostaen ammonium- ja hydroksidi-ioneja. Ensimmäinen, vähiten yleinen määritelmämme emäksestä on aine, joka muodostaa vedessä hydroksidi-ioneja. Ammoniakki on siis heikko emäs, eikä se etikkahapon tavoin johda sähköä läheskään yhtä hyvin kuin vesisuola. Ammoniakki on siis myös heikko elektrolyytti.
![]()
Kemiallisen yhtälömme symboliikka osoittaa jälleen heikon elektrolyytin reaktanttipainotteisen tasapainon.
Laajennukset ja yhteydet
Kvantitatiivisempi lähestymistapa tasapainoihin käyttää heikkoja happoja ja heikkoja emäksiä tärkeinä esimerkkeinä.




