Natriumkloridi, NaCl
Natriumkloridimolekyyli muodostuu ionisidoksen klassisessa tapauksessa natrium- ja klooriatomien ionisoitumisen ja syntyneiden ionien vetovoiman avulla.
Natriumatomilla on yksi 3s-elektroni suljetun kuoren ulkopuolella, ja tämän elektronin poistamiseen tarvitaan vain 5,14 elektronivoltin energia. Kloorilta puuttuu yksi kuoren täyttävä elektroni, ja se vapauttaa 3,62 eV hankkiessaan tuon elektronin (sen elektroniaffiniteetti on 3,62 eV) Tämä tarkoittaa, että yhden natriumin elektronin luovuttaminen kloorille vaatii vain 1,52 eV energiaa, kun ne ovat kaukana toisistaan. Kun syntyvät ionit tuodaan lähemmäs toisiaan, niiden sähköinen potentiaalienergia muuttuu yhä negatiivisemmaksi ja saavuttaa -1,52 eV:n arvon noin 0,94 nm:n etäisyydellä toisistaan. Tämä tarkoittaa, että jos neutraalit natrium- ja klooriatomit olisivat lähempänä kuin 0,94 nm, olisi energeettisesti suotuisaa siirtää elektroni Na:lta Cl:lle ja muodostaa ionisidos.
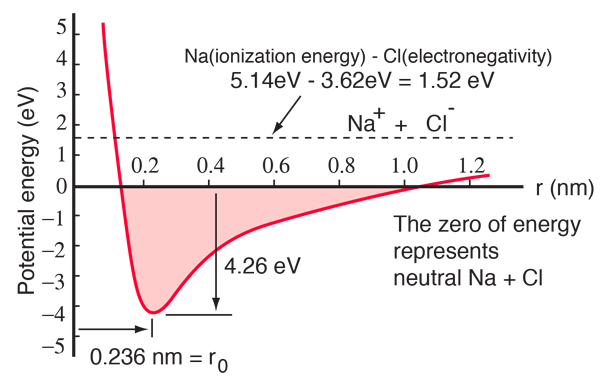
Potentiaalienergiakäyrästä nähdään, että 0,236 nm:n etäisyydellä toisistaan on minimi ja sen jälkeen potentiaalin jyrkkä nousu, joka edustaa hylkivää voimaa. Tämä repulsiivinen voima on enemmän kuin vain kahden atomin elektronipilvien välinen sähköstaattinen repulsio. Sillä on kvanttimekaaninen luonne, joka juontaa juurensa Paulin poissulkemisperiaatteeseen, ja sitä kutsutaan usein vain ”poissulkemisperiaatteen repulsioksi”. Kun ionit ovat kaukana toisistaan, niiden ydinelektronien aaltofunktiot eivät ole merkittävästi päällekkäisiä ja niillä voi olla identtiset kvanttiluvut. Kun ne lähestyvät toisiaan, aaltofunktioiden lisääntyvä päällekkäisyys aiheuttaa sen, että osa niistä pakotetaan korkeampiin energiatiloihin. Mikään kaksi elektronia ei voi olla samassa tilassa, joten kun yhdistettyyn kahden ytimen systeemiin muodostuu uusi joukko energiatiloja, alemmat energiatilat täyttyvät ja osa elektroneista työnnetään korkeampiin tiloihin. Tämä vaatii energiaa ja koetaan hylkimisenä, joka estää ioneja lähestymästä toisiaan.
Yllä oleva potentiaalidiagrammi koskee kaasumaista NaCl:ää, ja ympäristö on erilainen tavallisessa kiinteässä tilassa, jossa natriumkloridi (tavallinen ruokasuola) muodostaa kuutiomaisia kiteitä. Ionierotus on 0,28 nm, mikä on jonkin verran suurempi kuin kaasumaisessa tilassa.
Tärkeä osa molekyylien rakenteen tutkimista on atomien välille muodostuvien kemiallisten sidosten kuvaaminen. Klassisia tutkimuksia ovat ääripäiden ionisidokset natriumkloridissa ja kovalenttiset sidokset vetymolekyylissä.
| Kemialliset sidokset | Pauli-törmäys ionisidoksissa |
Sidosenergiaesimerkki




