6.17 : Ions polyatomiques
Notre discussion sur les composés ioniques s’est limitée aux ions monatomiques. Cependant, des ions plus complexes, contenant plusieurs atomes liés de manière covalente les uns aux autres, mais ayant une charge positive ou négative, apparaissent assez fréquemment en chimie. La charge apparaît parce que le nombre total d’électrons de valence des atomes ne peut pas produire une structure stable. L’ajout ou le retrait d’un ou plusieurs électrons permet d’obtenir une structure stable. Des exemples bien connus de tels ions polyatomiques sont l’ion sulfate (SO42-),
l’ion hydroxyde (OH-),
l’ion hydronium (H3O+),
et l’ion ammonium (NH4+).
Les atomes de ces ions sont reliés entre eux par des liaisons covalentes à paire d’électrons, et on peut dessiner des structures de Lewis pour les ions comme on le fait pour les molécules. La seule différence est que le nombre d’électrons dans l’ion n’équilibre pas exactement la somme des charges nucléaires. Soit il y a trop d’électrons, auquel cas nous avons un anion, soit il y en a trop peu, auquel cas nous avons un cation.
Pensons, par exemple, à l’ion hydroxyde (OH-) pour lequel la structure de Lewis est
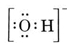
Une molécule neutre contenant un atome de O et un atome de H ne contiendrait que sept électrons, six de O et un de H. L’ion hydroxyde, cependant, contient un octuor d’électrons, un de plus que la molécule neutre. L’ion hydroxyde doit donc porter une seule charge négative. Afin de dessiner la structure de Lewis d’un ion donné, nous devons d’abord déterminer combien d’électrons de valence sont impliqués. Supposons que l’on ait besoin de la structure de H3O+. Le nombre total d’électrons est obtenu en additionnant les électrons de valence de chaque atome, soit 6 + 1 + 1 + 1 = 9 électrons. Nous devons maintenant soustraire 1 électron puisque l’espèce considérée n’est pas H3O mais H3O+. Le nombre total d’électrons est donc de 9 – 1 = 8. Comme il s’agit d’un octuor d’électrons, nous pouvons les placer tout autour de l’atome O. La structure finale suit alors très facilement :
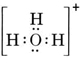
Dans des cas plus compliqués, il est souvent utile de calculer le nombre de paires d’électrons partagés avant de dessiner une structure de Lewis. Cela est particulièrement vrai lorsque l’ion en question est un oxyanion (c’est-à-dire qu’un atome central est entouré de plusieurs atomes O). Un oxyanion bien connu est l’ion carbonate, dont la formule est CO32-. (Notez que l’atome central C est écrit en premier, comme on l’a fait précédemment pour les molécules). Le nombre total d’électrons de valence disponibles dans CO32- est
\( 4 \text{(pour C)} + 3 fois 6 \text{(pour O)} + 2 \text{(pour la charge -2)} = 24 \)
Nous devons répartir ces électrons sur 4 atomes, en donnant à chacun un octet, soit une exigence de 4 × 8 = 32 électrons. Cela signifie que 32 – 24 = 8 électrons doivent être comptés deux fois pour les besoins de l’octuor, c’est-à-dire que 8 électrons sont partagés. L’ion a contient donc quatre liaisons par paire d’électrons. Vraisemblablement, l’atome de C est doublement lié à l’un des O et singulièrement lié aux deux autres:
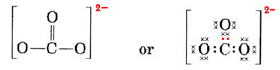
Dans ce diagramme, les 4 électrons de C ont été représentés par des points, les 18 électrons de O par des ×, et les 2 électrons supplémentaires par des points de couleur, pour faciliter la référence. Les électrons réels ne portent pas d’étiquettes de ce type ; ils sont tous identiques.
Il y a une objection sérieuse à la structure de Lewis qui vient d’être dessinée. Comment les électrons savent-ils quel atome d’oxygène isoler et former une double liaison avec, puisqu’il n’y a autrement rien pour différencier les oxygènes ? La réponse est qu’ils ne le savent pas. L’explication de la liaison dans l’ion CO32- et dans certaines autres molécules nécessite une extension de la théorie de Lewis. Nous poursuivrons cette question lorsque nous discuterons de la résonance. Nous terminons maintenant avec un exemple.
Exemple \(\PageIndex{1}\) : Structure de Lewis
Dessinez une structure de Lewis pour l’ion sulfite, SO32-.
Solution La méthode la plus sûre ici est de compter les électrons. Le nombre total d’électrons de valence disponibles est
6(pour S) + 3 × 6(pour O) + 2(pour la charge) = 26Pour faire quatre octets pour les quatre atomes, il faudrait 32 électrons, et donc la différence, 32 – 26 = 6, donne le nombre d’électrons partagés. Il n’y a donc que trois liaisons par paires d’électrons dans l’ion. L’atome central S doit être lié par une seule liaison à chaque atome O.
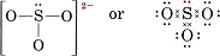
Notez que chacune des liaisons S-O est covalente coordonnée.
Contributeurs
-
Ed Vitz (Université de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff et Adam Hahn.




