CHEM 101 – Électrolytes
Sujets de chimie générale
Électrolytes
La dissociation des composés ioniques dans l’eau entraîne la formation d’espèces ioniques aqueuses mobiles.Équations chimiques de dissolution et de dissociation dans l’eau. Électrolytes forts et faibles.
Les électrolytes (accompagnement musical de ce sujet) sont des substances qui créent des espèces ioniques en solution aqueuse. L’existence de porteurs de charge en solution peut être démontrée par une expérience simple. La conductivité des milieux aqueux peut être observée en utilisant une paire d’électrodes, reliées à une source de tension, qui sont immergées dans la solution. Le courant que la solution conduit alors peut être facilement mesuré, et une ampoule électrique peut être utilisée comme indicateur visuel de la conductivité d’une solution.
Lorsque cette expérience est réalisée avec de l’eau pure, l’ampoule ne brille pas du tout. L’eau elle-même ne conduit pas facilement l’électricité ; c’est un exemple de substance moléculaire qui est un non-électrolyte. C’est également le cas de nombreuses autres substances moléculaires. Par exemple, le sucre de table (saccharose, C12H22O11) est très soluble dans l’eau, mais une solution de sucre ne conduit apparemment pas mieux l’électricité que l’eau seule. En revanche, lorsque nous réalisons l’expérience avec un composé ionique librement soluble comme le chlorure de sodium, l’ampoule brille de mille feux.
Représentons ce que nous pensons qu’il se passe avec ces cas contrastés de dissolution d’un composé moléculaire et d’un composé ionique en écrivant les équations chimiques suivantes :
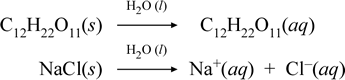
La première équation ci-dessus représente la dissolution d’un non-électrolyte, le composé moléculaire saccharose. La seconde équation représente la dissolution d’un composé ionique, le chlorure de sodium.La distinction clé entre les deux équations chimiques dans ce cas est la formation dans cette dernière d’espèces ioniques aqueuses comme produits. Les ions sont libres de diffuser individuellement dans un mélange homogène, et lorsqu’une tension est appliquée, les ions se déplacent selon la différence d’énergie potentielle électrique entre les électrodes, transportant ainsi un courant électrique. Notez que l’eau n’est pas représentée du côté du réactif dans ces équations, mais qu’elle figure au-dessus de la flèche, ce qui indique que l’eau détermine l’environnement dans lequel le processus de dissolution se produit. Le statut superstoechiométrique de l’eau dans ce symbolisme peut être interprété comme un processus de dissolution se produisant avec l’eau comme solvant. Nous n’écrirons pas l’eau comme un réactif dans la formation d’une solution aqueuse par un simple processus de dissolution. Il existe de nombreux cas dans lesquels une substance réagit avec l’eau lorsqu’elle se mélange et se dissout dans l’eau. Cette réaction d’un soluté en solution aqueuse donne lieu à des produits chimiquement distincts. Dans de tels cas, l’eau peut être explicitement représentée dans l’équation chimique comme une espèce réactive.
Electrolytes forts et faibles
Il s’avère que lorsqu’un composé ionique soluble tel que le chlorure de sodium subit une dissolution dans l’eau pour former une solution aqueuse constituée d’ions solvatés, la flèche vers la droite utilisée dans l’équation chimique est justifiée dans la mesure où (tant que la limite de solubilité n’est pas atteinte) le chlorure de sodium solide ajouté à l’eau solvatée se dissocie complètement. En d’autres termes, il y a effectivement 100 % de conversion de NaCl(s) en Na+(aq) et Cl-(aq). Par conséquent, dans notre expérience de conductivité, une solution de chlorure de sodium est hautement conductrice en raison de l’abondance des ions, et l’ampoule brille de mille feux. Dans ce cas, nous disons que le chlorure de sodium est un électrolyte fort.
En revanche, considérons la substance moléculaire qu’est l’acide acétique, HC2H3O2.Lorsque l’acide acétique est dissous dans l’eau, il forme une espèce moléculaire non dissociée, solvatée, symbolisée par HC2H3O2(aq), comme dans le cas du saccharose ci-dessus. Cependant, lorsque nous effectuons notre test de conductivité avec une solution d’acide acétique, nous constatons que l’ampoule brille, bien qu’assez faiblement par rapport à la luminosité observée pour la solution de chlorure de sodium. Dans ce cas, il doit y avoir une formation au moins partielle d’ions d’acide acétique dans l’eau. Une équation chimique représentant ce processus doit montrer la production d’ions. Une proposition raisonnable pour une telle équation serait:
![]()
Deux choses sont importantes à noter ici. Premièrement, il s’agit d’un cas où nous incluons l’eau comme réactif. Les deux substances moléculaires, l’eau et l’acide acétique, réagissent pour former les ions polyatomiques hydronium et acétate. L’équation représentant ce phénomène est une équation ionique. La deuxième caractéristique qui mérite une discussion plus approfondie est le remplacement de la flèche vers la droite par le symbole de la double flèche à un seul trait, qui signifie un équilibre chimique. Dans ce cas, la condition d’équilibre de la réaction favorise les réactifs, ce qui signifie que dans une solution aqueuse d’acide acétique, la plus grande partie de l’acide acétique reste sous forme de molécules d’acide acétique, seule une petite proportion à tout moment ayant cédé H+ à l’eau pour former les ions. Le petit nombre d’ions produits explique pourquoi la solution d’acide acétique ne conduit pas l’électricité aussi bien que la solution de chlorure de sodium, ce qui se traduit par une faible illumination de l’ampoule de notre détecteur de conductivité. On distingue donc les électrolytes forts, comme le chlorure de sodium, et l’acide acétique, qui est un exemple d’électrolyte faible.
Comme le suggère le nom d’acide acétique, cette substance est également un acide, ainsi qu’un électrolyte faible. En conséquence, nous classons l’acide acétique comme un acide faible. Notre première définition (et la moins générale) d’un acide est une substance qui crée de l’ion hydronium dans l’eau, ce qui est exactement ce que montre notre équation ionique ci-dessus, sachant qu’un acide faible crée des quantités relativement faibles d’ion hydronium.
Les chimistes aiment beaucoup les abréviations, et une abréviation importante pour l’ion hydronium est H+(aq), et elle est couramment utilisée. Ceci est illustré dans la version abrégée de l’équation ci-dessus qui est montrée juste en dessous. Pour être clair, H+ lui-même serait juste un proton isolé (pour 1H) ; il est donc également important de noter qu’aucune espèce de ce type n’existe en solution aqueuse.
De plus, les flèches ont été faites de longueur inégale pour indiquer l’équilibre favorisant le réactif, dans lequel il y a beaucoup moins d’ions que de molécules d’acide acétique.
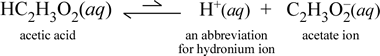
En représentant l’hydronium comme H+(aq), l’équation ionique de l’acide acétique dans l’eau est formellement équilibrée sans inclure une molécule d’eau comme réactif, ce qui est implicite dans l’équation ci-dessus.
Ammonia : Un exemple d’électrolyte faible qui est une base faible
L’acide acétique comme nous venons de le voir est un composé moléculaire qui est un acide faible et un électrolyte. L’ammoniac, NH3, un autre composé moléculaire simple, réagit également dans une faible mesure avec l’eau, en formant des ions ammonium et hydroxyde. Notre première définition, la moins générale, d’une base est une substance qui crée des ions hydroxyde dans l’eau. Ainsi, l’ammoniac est une base faible et, comme l’acide acétique, il est loin de conduire l’électricité aussi bien qu’un sel aqueux. L’ammoniac est donc également un électrolyte faible.
![]()
Le symbolisme de notre équation chimique indique à nouveau un équilibre favorisé par le réactif pour l’électrolyte faible.
Extensions et connexions
Une approche plus quantitative des équilibres utilise les acides faibles et les bases faibles comme exemples importants.




