CHEM 245 – Inhibition enzymatique
Sujets de biochimie
Inhibition enzymatique
Types d’inhibiteurs et inhibition.Inhibiteurs et inhibition réversibles et irréversibles. Modèles pour et effets cinétiques de l’inhibition compétitive et non-compétitive. Inhibition mixte.Exemples d’inhibition enzymatique.
La spécificité des enzymes n’est pas strictement limitée aux substrats. Souvent, l’activité d’une enzyme est réduite par des interactions spécifiques avec des molécules appelées inhibiteurs. L’inhibition des enzymes est l’un des phénomènes les plus importants en biochimie. Par exemple, de nombreux médicaments, antibiotiques et toxines exercent leurs effets par leur capacité à inhiber une enzyme. Les inhibiteurs dont la structure est similaire à celle du substrat sont souvent des inhibiteurs compétitifs, car ils sont en concurrence pour se lier au site actif. L’inhibition d’une enzyme peut être réversible (comme c’est généralement le cas lorsqu’un inhibiteur se lie à l’enzyme via des interactions non covalentes) ou irréversible (comme cela se produit dans de nombreux cas où les inhibiteurs agissent via des modifications covalentes de l’enzyme, ciblant peut-être un résidu critique pour la catalyse).
Nous pouvons imaginer plusieurs modèles simples d’inhibition réversible. Le plus simple d’entre eux est l’occlusion directe du site actif par l’inhibiteur. Ceci serait vu dans le cas d’une molécule ayant une certaine similarité structurelle avec le substrat. La liaison du substrat et de l’inhibiteur s’excluent mutuellement dans ce modèle d’inhibition compétitive.
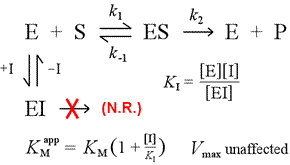
À droite est montré un modèle mécaniste simple pour l’inhibition compétitive. L’inhibiteur, I, se lie uniquement à l’enzyme libre E, avec une constante de dissociation KI , et bloque la liaison du substrat (S). En immobilisant une partie de l’enzyme dans le complexe EI inactif, une quantité moindre de l’enzyme est disponible à une concentration de substrat donnée pour se combiner avec le substrat et former ES, puis potentiellement se convertir en produits. Une augmentation du nécessaire pour atteindre la ½Vmax sera observée, d’où la valeur apparente du KM augmente.
En augmentant à des niveaux toujours plus élevés, le substrat peut submerger l’inhibiteur, le surpasser pour l’enzyme libre dans la mesure où le véritable Vmax peut encore être approché.
Nous pouvons facilement imaginer qu’une molécule qui ressemble au substrat dans certaines caractéristiques structurelles clés pourrait concurrencer le substrat pour la liaison le au site actif. C’est ce qu’on appelle un analogue de substrat, et ils fournissent des exemples courants d’inhibiteurs compétitifs d’enzymes. Si la façon dont les enzymes améliorent les taux de réaction est en stabilisant sélectivement l’état de transition de la réaction, alors si nous pouvons trouver une molécule qui ressemble à l’état de transition (dans la structure et la polarité ou la charge), un tel analogue d’état de transition devrait être un très bon inhibiteur compétitif.
Nous allons opposer le modèle d’inhibition compétitive à l’inhibition non compétitive, dans laquelle l’inhibiteur se lie uniquement au complexe enzyme-substrat. On peut imaginer que cela se produit à la suite d’une interaction enzyme-substrat de type conformation induite, dans laquelle un site de liaison pour un inhibiteur est disponible exclusivement dans la conformation induite de l’ES.
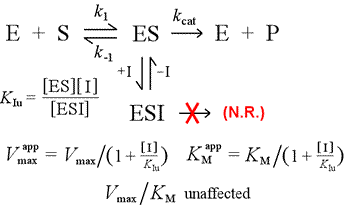
Gauche : Un modèle mécaniste d’inhibition non compétitive. Dans ce modèle, l’inhibiteur se lie uniquement au complexe ES, et non à l’enzyme libre. Le complexe ternaire, ESI, ne se transforme pas en produits. Ceci a pour effet d’abaisser la Vmax apparente. La constante de dissociation de l’inhibiteur pour l’ESI est désignée par KIu. Dans un effet expliqué par le principe de Le Châtelier, le KM apparent est plus faible, car la liaison de l’inhibiteur élimine une partie du produit (ES) de » l’équilibre » de formation de l’ES.
Un modèle d’inhibition dans lequel l’inhibiteur se lie à la fois à l’enzyme libre et au complexe enzyme-substrat est l’inhibition mixte. La constante de dissociation de l’inhibiteur peut différer entre E et ES (c’est-à-dire KI ≠ KIu). Le cas particulier où KI = KIu porte le nom d’inhibition non compétitive. Notons que dans ce cas, KM n’est pas affecté, alors que Vmax est abaissé.
Types d’inhibition réversible des enzymes – un résumé
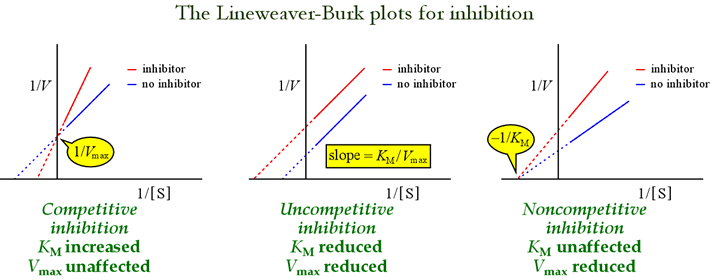
Nous avons vu que les différents modèles d’inhibition réversible peuvent être distingués en fonction des effets sur les paramètres cinétiques. Le tableau ci-dessous résume les types d’inhibition et leurs effets sur ces paramètres.

Les graphes de Lineweaver-Burk, ou double-réciproque sont utiles pour identifier les modèles d’inhibition. La figure ci-dessous montre comment différents types d’inhibition affectent le graphe.
Exemples d’inhibition enzymatique
Le premier et le plus largement utilisé des médicaments, l’acétylsalicylate (salicylate = orthohydroxybenzoate), communément appelé aspirine, est un analgésique (antidouleur), un antipyrétique (réducteur de fièvre) et un anti-inflammatoire efficace. Les propriétés médicinales de l’écorce de saule étaient connues dans certaines cultures depuis des siècles. Au XIXe siècle, on a découvert que l’ingrédient actif était une combinaison d’alcool et d’alcool salicylique. Sur la base de ces observations et d’autres, ainsi que des progrès de la synthèse chimique, l’aspirine est devenue disponible au milieu du siècle, après avoir été préparée par Hoffman, un chimiste employé par Bayer. Des recherches plus modernes ont établi que les propriétés médicinales de l’aspirine proviennent en grande partie de sa capacité à inhiber de manière irréversible une enzyme connue sous le nom de cyclooxygénase, qui est nécessaire à la synthèse des prostaglandines et des thromboxanes.
Les cyclooxygénases catalysent la première étape de la conversion de l’arachidonate en un précurseur des prostaglandines et des thromboxanes, la prostaglandine G2 (PGG2, structures et réaction). La réaction utilise deux molécules d’O2 et convertit l’acide gras C20:4 en une molécule peroxydée contenant un cycle cyclopentane (PGG2 – PG signifie « prostaglandine »). L’enzyme cyclooxygénase possède également une activité hydroperoxydase qui convertit le PGG2 en PGH2. Ainsi, la « cyclooxygénase » (COX) serait plus précisément désignée comme la prostaglandine endoperoxyde H synthase (PGHS). L’inhibition de l’activité de la cyclooxygénase par l’aspirine est due à sa capacité à modifier chimiquement un résidu sérine (Ser530) de l’enzyme. Le résidu sérine acquiert un groupe acétyle à partir de l’aspirine, une modification irréversible. Ainsi, l’aspirine est un exemple d’inhibiteur irréversible. Il existe en fait deux isozymes de la COX : une forme constitutive, la COX-1 (PGHS-1), et une forme induite (dans des conditions d’inflammation), la COX-2 (PGHS-2). Les anti-inflammatoires non stéroïdiens (AINS) tels que l’aspirine, l’ibuprofène et le naproxène inhibent généralement les deux isoformes. Par conséquent, ces médicaments produisent des effets secondaires indésirables, par exemple une irritation gastro-intestinale. Ainsi, un objectif actuel de la recherche pharmacologique est de développer des inhibiteurs spécifiques de la COX-2, un effet qui est censé médier la plupart des effets analgésiques et anti-inflammatoires des AINS.
Pages de sujets connexes :
- introduction à la cinétique chimique
- introduction à l’enzymologie
- cinétique enzymatique
- équation de Michaelis-Menten
.




