Faits sur le baryum
Du nom du mot grec barys pour « lourd », le baryum est un métal alcalino-terreux relativement dense et réactif. On ne le trouve à l’état naturel que lorsqu’il est combiné à d’autres éléments, et les composés contenant du baryum ont un large éventail d’utilisations ; on les trouve dans la mort-aux-rats, les agents de pondération dans les fluides de forage pétrolier et le fluide blanc utilisé pour visualiser les intestins dans un test de diagnostic par rayons X appelé lavement au baryum.
Les faits
- Numéro atomique (nombre de protons dans le noyau) : 56
- Symbole atomique (sur le tableau périodique des éléments) : Ba
- Poids atomique (masse moyenne de l’atome) : 137,327
- Densité : 2,09 onces par pouce cube (3.62 grammes par cm cube)
- Phase à température ambiante : solide
- Point de fusion : 1 341 degrés Fahrenheit (727 degrés Celsius)
- Point d’ébullition : 3 447 F (1 897 C)
- Nombre d’isotopes naturels (atomes du même élément avec un nombre différent de neutrons) : 7
- Isotope le plus courant : Ba-138
Découverte du baryum
Vincenzo Casciarolo, un alchimiste italien du XVIIe siècle, a remarqué pour la première fois le baryum sous la forme de cailloux inhabituels qui brillaient pendant des années après avoir été exposés à la chaleur, selon la Royal Society of Chemistry. Il a nommé ces cailloux « pierres de Bologne », du nom de sa ville natale, mais il a été déterminé plus tard qu’il s’agissait de sulfate de baryum (BaSO4). À la fin du 18e siècle, l’oxyde de baryum (BaO) et le carbonate de baryum (BaCO3) ont été découverts respectivement par le chimiste allemand Carl Scheele et le chimiste anglais William Withering.
Le baryum métal pur n’a pas été isolé et identifié avant 1808 à la Royal Institution de Londres. L’éminent chimiste et inventeur Sir Humphry Davy a utilisé l’électrolyse pour séparer le baryum des sels de baryum fondus tels que l’hydroxyde de baryum (Ba(OH)2). Pendant l’électrolyse, un courant électrique traverse la substance ionique afin de séparer les ions les uns des autres. Comme les sels de baryum étaient fondus, les ions de baryum se sont facilement déplacés vers le récipient avec l’électrode négative, et les autres ions négatifs se sont facilement déplacés dans la direction opposée vers le récipient avec l’électrode positive.
Sources de baryum
Le baryum ne se trouve naturellement qu’en combinaison avec d’autres éléments en raison de son haut niveau de réactivité. On trouve le plus souvent le baryum combiné avec du sulfate et du carbonate, mais il peut aussi former des composés avec de l’hydroxyde, du chlorure, du nitrate, du chlorate et d’autres ions négatifs. Environ 0,05 % de la croûte terrestre est composée de baryum, ce qui en fait le 17e élément le plus abondant de la croûte, selon Robert E. Krebs dans son livre « The History and Use of Our Earth’s Chemical Elements : A Reference Guide » (Greenwood Publishing Group, 2006). Les réserves minières du Royaume-Uni, de l’Italie, de la République tchèque, des États-Unis et de l’Allemagne contiennent plus de 400 millions de tonnes de baryum, selon John Emsley dans son livre « Nature’s Building Blocks : An A-Z Guide to the Elements » (Oxford University Press, 1999).
Pour obtenir du baryum élémentaire pur, il faut le séparer des autres éléments présents dans les composés naturels du baryum. Le baryum peut être extrait du chlorure de baryum par électrolyse. On peut également obtenir du baryum en réduisant l’oxyde de baryum à l’aide d’aluminium ou de silicium dans un vide à haute température et basse pression.
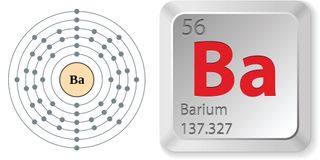
Propriétés du baryum
Le baryum pur est un métal blanc argenté et mou. Classé parmi les métaux alcalino-terreux, il est situé dans le groupe, ou colonne, 2 du tableau périodique, avec le béryllium, le magnésium, le calcium, le strontium et le radium. Chacun de leurs atomes contient deux électrons de valence (les plus externes). Le baryum se trouve dans la période, ou rangée, 5, il détient donc ses électrons de valence dans sa cinquième coquille et peut perdre les électrons, ou s’oxyder, très facilement. Cela explique le haut niveau de réactivité du baryum, en particulier avec les éléments électronégatifs comme l’oxygène.
Utilisations commerciales du baryum
Le baryum élémentaire n’a pas beaucoup d’utilisations pratiques, encore une fois en raison de son haut niveau de réactivité. Cependant, sa forte attraction pour l’oxygène le rend utile comme « getter » pour éliminer les dernières traces d’air dans les tubes à vide. Le baryum pur peut également être combiné à d’autres métaux pour former des alliages utilisés pour fabriquer des éléments de machine tels que des roulements ou des bougies d’allumage dans les moteurs à combustion interne. Parce que le baryum a une prise lâche sur ses électrons, ses alliages émettent facilement des électrons lorsqu’ils sont chauffés et améliorent l’efficacité des bougies d’allumage, selon Krebs.
Les composés contenant du baryum ont une variété d’utilisations commerciales. Le sulfate de baryum, ou barytine, est utilisé dans le lithopone (un pigment éclaircissant dans le papier d’imprimante et la peinture), les fluides de forage de puits de pétrole, la fabrication de verre et la création de caoutchouc. Le carbonate de baryum est utilisé comme raticide, et le nitrate de baryum et le chlorate de baryum produisent des couleurs vertes dans les feux d’artifice.
Le baryum dans votre corps
L’adulte moyen contient environ 22 mg de baryum car il est présent dans des aliments tels que les carottes, les oignons, la laitue, les haricots et les céréales. Les niveaux de baryum dans vos dents peuvent en fait aider les scientifiques à déterminer le moment où les bébés passent de l’allaitement au sein à la consommation d’aliments solides. Ces faibles niveaux de baryum ne jouent aucun rôle biologique et ne sont pas dangereux.
Par contre, de grandes quantités de sels de baryum solubles peuvent être toxiques et même mortelles, selon John Emsley dans son livre « The Elements of Murder : A History of Poison » (Oxford University Press, 2005). Le baryum peut provoquer des vomissements, des coliques, des diarrhées, des tremblements et des paralysies. Quelques meurtres ont été commis avec des composés de baryum, notamment le meurtre en 1994 d’un homme à Mansfield, au Texas, par sa fille de 16 ans, Marie Robards, qui avait volé de l’acétate de baryum dans le laboratoire de chimie de son école secondaire. Plusieurs patients ont également été accidentellement tués par le baryum lorsque du carbonate de baryum soluble plutôt que du sulfate de baryum insoluble a été utilisé par erreur lors d’un test de diagnostic gastro-entérologique (GI) appelé lavement baryté.
Les médecins effectuent des lavements barytés afin de visualiser et de diagnostiquer les anomalies du gros intestin et du rectum, selon la médecine Johns Hopkins. Au cours de la procédure, du sulfate de baryum est instillé par le rectum pour recouvrir les parois internes du gros intestin. De l’air est généralement administré ensuite pour s’assurer que le revêtement de baryum remplit toutes les anomalies de surface. Ensuite, des rayons X sont utilisés pour produire une image du tube digestif inférieur. Le sulfate de baryum absorbe les rayons X et apparaît en blanc sur le film radiographique, contrairement à l’air et aux tissus environnants qui apparaissent en noir. L’analyse de l’image radiographique du lavement baryté permet aux médecins de diagnostiquer des troubles tels que la colite ulcéreuse, la maladie de Crohn, les polypes, le cancer et le syndrome du côlon irritable.




