Frontiers in Pharmacology
Introduction
L’olanzapine est l’un des antipsychotiques de deuxième génération (SGA) les plus utilisés pour la schizophrénie, le trouble bipolaire et les symptômes psychotiques. Outre l’amélioration des principaux symptômes de la psychose, l’olanzapine présente une grande acceptabilité, diminue les abandons de traitement toutes causes confondues et prévient les rechutes futures (Leucht et al., 2009). De nombreux essais cliniques randomisés (ECR) et méta-analyses ont suggéré que l’olanzapine est l’un des antipsychotiques les plus efficaces chez les patients atteints de schizophrénie (Leucht et al., 2013 ; Huhn et al., 2019).
Les effets indésirables les plus fréquents de l’olanzapine sont la prise de poids (Allison et al., 1999). L’olanzapine suscite le plus de prise de poids parmi les SGA. L’essai CAFE (Comparison of Atypicals for First Episode) a démontré que 80 % des patients traités par olanzapine ont pris plus de 7 % de leur poids initial à la semaine 52 (McEvoy et al., 2007). Le taux d’abandon de l’olanzapine en raison de la prise de poids ou des effets métaboliques qui l’accompagnent était 2 à 8 fois plus élevé que celui des autres antipsychotiques dans l’essai CATIE (Clinical Antipsychotic Trials in Intervention Effectiveness) (Lieberman et al., 2005). En plus d’être associée à une diminution de l’adhésion au traitement médicamenteux, la prise de poids est également associée à une morbidité et une mortalité médicales substantielles. Compte tenu du taux élevé d’obésité chez les patients atteints de schizophrénie (42 %), le risque potentiel de prise de poids induite par l’olanzapine doit être évalué avec soin (Newcomer, 2006). Certaines études d’essais contrôlés randomisés (ECR) ont révélé que les patients atteints de maladies mentales meurent jusqu’à 30 ans plus tôt que la population générale (Das-Munshi et al., 2017). La principale cause de décès dans cette population est la maladie cardiaque. Un facteur de risque majeur de maladie cardiaque et de décès prématuré chez ces patients est la prise de poids (Fekadu et al., 2015).
Les mécanismes qui sous-tendent la prise de poids et les effets métaboliques indésirables induits par les antipsychotiques ne sont pas bien compris (Correll et al., 2011). L’olanzapine est associée à une augmentation de l’appétit et de la prise alimentaire et à une diminution de l’activité ou à une altération de la régulation métabolique (Roerig et al., 2005 ; Henderson et al., 2015). Fountaine et al. ont rapporté que chez des hommes en bonne santé, l’olanzapine augmentait le poids corporel par une augmentation de la prise alimentaire, sans preuve d’une diminution des niveaux d’activité ou de dépense (Fountaine et al., 2010). Cette observation est en accord avec les observations faites sur des adolescents masculins hospitalisés pour schizophrénie (Gothelf et al., 2002). Les patients présentaient une augmentation significative de l’indice de masse corporelle due à une augmentation de l’apport calorique après un traitement de 4 semaines par olanzapine (Gothelf et al., 2002). Cependant, les données actuelles concernant l’association entre l’appétit et la prise de poids ne sont pas concluantes (Poyurovsky et al., 2007 ; Case et al., 2010). Case et al. ont signalé que les changements précoces de l’appétit n’étaient pas systématiquement corrélés à la variation globale du poids dans quatre essais différents (Case et al., 2010). De plus, aucune étude n’a rapporté le moment exact de l’augmentation de l’appétit, comparé la vitesse de prise de poids par rapport au moment de l’augmentation de l’appétit, ou évalué les différences de prise de poids et les effets métaboliques entre les patients ayant un appétit accru ou inchangé. Par conséquent, nous avons évalué l’association entre l’augmentation de l’appétit et les changements de poids induits par l’olanzapine et les effets métaboliques qui les accompagnent chez les patients en premier épisode de schizophrénie naïfs de médicaments.
Matériel et méthodes
Participants
Cette étude a été menée à l’Institut de santé mentale du deuxième hôpital Xiangya, Université centrale du Sud, en Chine, entre décembre 2016 et avril 2019. Les participants ont été évalués pour la schizophrénie conformément aux critères définis par le Manuel diagnostique et statistique des troubles mentaux – cinquième édition (DSM-5) (Association A.P., 2013). Comme les patients naïfs d’antipsychotiques/de premier épisode semblent prendre plus de poids après un traitement par olanzapine (Correll et al, 2011), nous avons inclus les patients atteints de schizophrénie en premier épisode âgés de 18 à 50 ans ont été inclus dans cette étude.
Les critères d’exclusion comprenaient (i) des résultats cliniquement anormaux des examens physiques, des tests de laboratoire ou des résultats d’électrocardiogramme (ECG) ; (ii) des troubles tels que la déficience intellectuelle, le trouble de la consommation de substances ou d’alcool, un diagnostic d’autres maladies systémiques spécifiques selon les critères du DSM-5 ; (iii) des maladies cardiovasculaires et métaboliques telles que le diabète sucré, la dyslipidémie et l’hypertension ; (iv) des antécédents de troubles alimentaires ; (v) un régime alimentaire strict dans le mois précédant le dépistage ou pendant l’étude ; et (vi) une grossesse ou un allaitement.
Intervention
Des études antérieures ont suggéré que le taux de prise de poids induit par l’olanzapine était le plus rapide au cours des 12 premières semaines de traitement (Correll et al, 2009). Par conséquent, les participants ont été traités à l’olanzapine (15-20 mg/jour à 20 h) pendant 12 semaines. La dose initiale d’olanzapine était de 5 mg/jour, puis ajustée à 15-20 mg/jour au cours de la première semaine.
Évaluation
Les évaluations de base comprenaient des données démographiques, un historique médical complet, des mesures anthropométriques (poids et taille), l’appétit, un examen physique et des analyses de laboratoire. L’appétit a été évalué quotidiennement, 30 minutes avant le déjeuner, à l’aide de quatre questions standardisées : Faim, Sentiment de satiété, Pensée à la nourriture, et Suralimentation. Les réponses étaient notées sur une échelle de 0 à 10, où 0 = « pas du tout » et 10 = « extrêmement ». Une augmentation de l’appétit a été définie comme une augmentation de >10% des scores de base de l’appétit. La diminution de l’appétit a été définie comme une diminution de >10% des scores de base de l’appétit. L’échelle du syndrome positif et négatif (PANSS) a été utilisée pour évaluer la sévérité des symptômes de la schizophrénie. Les effets indésirables ont été évalués par l’échelle des symptômes émergents du traitement (TESS). À chaque visite de suivi, toutes les évaluations de base (y compris l’examen physique, les mesures anthropométriques, l’appétit et la TESS) ont été répétées, à l’exception du PANSS. Le PANSS a été réévalué à la semaine 12.
Avant le traitement et à jeun, le poids et la taille ont été mesurés après que les participants aient retiré leurs chaussures avec des vêtements légers d’intérieur. L’appétit était évalué avant le déjeuner et était basé sur le jugement du médecin évaluateur le jour de l’examen. Les analyses de laboratoire, notamment le glucose plasmatique et les fonctions hépatique et rénale, ont été évaluées à l’aide de procédures enzymatiques avec l’analyseur chimique automatisé Boehringer Mannheim/Hitachi 714. L’insuline a été mesurée à l’aide d’un test immuno-enzymatique en phase solide (ELISA).
Les résultats primaires étaient le pourcentage de patients qui avaient une augmentation de l’appétit et la période de temps entre le traitement à l’olanzapine et l’augmentation de l’appétit. Les résultats secondaires comprenaient les changements de poids, l’indice de masse corporelle (IMC), la glycémie à jeun, l’insuline à jeun et l’indice de résistance à l’insuline, les profils lipidiques comprenant les triglycérides, le cholestérol, les lipoprotéines de haute densité (HDL-C) et les lipoprotéines de basse densité (LDL-C), et le score PANSS. L’IMC a été calculé selon les critères du groupe de travail sur l’obésité en Chine : poids sain (18,5 ≤ IMC <25 kg/m2), surpoids (25 ≤ IMC ≤ 28 kg/m2) et obésité (IMC > 28 kg/m2). La dyslipidémie a été définie comme un taux de cholestérol ≥ 5,18 mmolċl-1, de triglycérides ≥ 1,70 mmolċl-1, de HDL-C < 1,04 mmolċl-1, ou de LDL-C ≥ 3,37 mmolċl-1, selon les directives chinoises sur la dyslipidémie (Hu, 2017). Une analyse de la proportion de patients qui ont gagné plus de 7 % de leur poids corporel de base après 12 semaines, qui est le seuil de la prise de poids cliniquement significative, a également été incluse (Kanders et al., 1991).
Analyse statistique
Paquet statistique pour les sciences sociales, version 25.0 (SPSS v25.0) a été employé pour l’analyse statistique. Les variables continues et les variables catégorielles sont décrites à l’aide de statistiques sommaires (moyennes et écarts types) ou de fréquences et de pourcentages, respectivement. Le test t de Student et les analyses du chi carré ont été utilisés pour analyser les différences entre les groupes en ce qui concerne les changements de poids corporel, d’IMC, de glycémie et d’insuline à jeun, d’indice de résistance à l’insuline, de triglycérides, de cholestérol, de C-HDL et de C-LDL entre le début de l’étude et chaque point temporel. Nous avons étudié l’association entre le poids, l’IMC, l’indice de résistance à l’insuline, le LDL-C et l’appétit en utilisant une analyse de régression linéaire. Une valeur P (p) < 0,05 a été considérée comme statistiquement significative.
Résultats
Au total, 33 patients hospitalisés pour schizophrénie (âge moyen, 23,5 ans ; fourchette 18-36 ans) ont été inscrits à l’étude. Il y avait une plus grande proportion de patients de sexe féminin (63,6%, 21/33). Tous les patients se situaient dans la fourchette normale de l’IMC (IMC moyen, 21,3 ± 1,7 kg/m2). La durée moyenne de la schizophrénie était de 11,2 ± 3,7 (intervalle 5-18) mois. Deux patientes ont abandonné l’étude après 4 semaines en raison d’une augmentation de l’appétit ; les 31 autres participants (93,9 %) ont terminé l’étude (tableau 1).
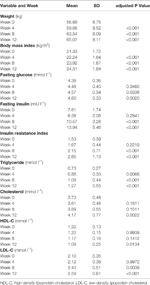
Tableau 1 Résumé du poids et des mesures métaboliques par étude.
Augmentation de l’appétit après le traitement par l’olanzapine
Après un traitement par l’olanzapine de 12 semaines, 77,4% (24/31) des patients avaient une augmentation de l’appétit et 22,6% (7/31) des patients avaient un appétit inchangé. Comme le montre la figure 1, pour les 24 patients qui ont eu une augmentation de l’appétit, l’augmentation de l’appétit a commencé dans les 8 premières semaines du traitement par olanzapine et a duré jusqu’à la fin du traitement. Le délai moyen entre le début du traitement à l’olanzapine et l’augmentation de l’appétit était de 20,3 jours (écart-type = 14,4), et 25,0 % (6/24) et 70,8 % (17/24) ont augmenté leur appétit en 1 semaine et 4 semaines, respectivement. Deux patients ont augmenté leur appétit le 3ème jour après le traitement à l’olanzapine. Aucune différence significative n’a été trouvée dans l’appétit induit par l’olanzapine entre les différents sexes en utilisant l’analyse à deux voies ANOVA.
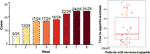
Figure 1 Nombre de patients ayant augmenté leur appétit pendant les périodes de traitement par olanzapine de 8 semaines.
Changements du poids corporel et de l’IMC après le traitement par olanzapine
Des augmentations significatives du poids et de l’IMC ont été observées après le traitement par olanzapine (tableau 1). La prise de poids moyenne a été de 7,9 kg pendant la période de 12 semaines de traitement par olanzapine, les patients ayant pris 2,4, 4,0 et 1,5 kg respectivement lors de la première, deuxième et troisième période de 4 semaines. Les patients de sexe féminin étaient plus susceptibles de prendre du poids (P < 0,001), avec une prise de poids moyenne de 9,19 kg pendant la période d’étude, contre 5,90 kg chez les patients de sexe masculin. Sur l’ensemble des patients, 80,6 % (25/31) et 61,3 % (19/31) ont augmenté leur poids corporel initial de plus de 7 % et 10 %, respectivement, au cours du traitement de 12 semaines par l’olanzapine (tableau supplémentaire 1). Après 12 semaines, 51,6 % (16/31) des patients sont devenus en surpoids (IMC>25 kg/m2).
Changements des perturbations métaboliques après le traitement par olanzapine
Des augmentations significatives de la glycémie à jeun, de l’insuline à jeun, de l’indice de résistance à l’insuline, des triglycérides, du cholestérol et du LDL-C et des diminutions du HDL-C ont été observées à 12 semaines (tableau 1). Aucun patient inclus dans l’étude ne présentait de dyslipidémie au départ. Sur la base des directives chinoises pour la dyslipidémie, 38,7 % (12/31) des patients présentaient une dyslipidémie après 12 semaines de traitement par olanzapine.
Augmentation de l’appétit et prise de poids induite par l’olanzapine
Afin de détecter l’effet de l’augmentation de l’appétit sur la prise de poids induite par l’olanzapine, nous avons divisé les patients en deux groupes (groupe appétit augmenté et groupe appétit inchangé ) selon que l’appétit augmentait ou non après 12 semaines de traitement par olanzapine.
Par rapport au groupe à appétit inchangé, il y avait des augmentations significatives du poids et des niveaux d’IMC dans le groupe à appétit accru après 12 semaines de traitement à l’olanzapine (tableau 2). La figure 2 a montré la comparaison de la prise de poids et des résultats liés au métabolisme entre les groupes à appétit accru et inchangé. Des analyses détaillées ont été présentées dans le tableau supplémentaire 2. Le gain de poids entre les deux groupes était significatif (P = 0,01) en utilisant l’analyse ANOVA à deux voies. Le poids moyen a augmenté de 9,1 kg (ET = 4,1) dans le groupe à appétit accru et de 3,9 kg (ET = 2,0) dans le groupe à appétit inchangé, avec une différence significative entre les deux groupes pendant la période de traitement de 12 semaines par l’olanzapine. Un plus grand pourcentage de patients (91,7 %) dans le groupe à appétit accru ont gagné plus de 7 % de leur poids corporel initial après 12 semaines par rapport aux patients du groupe à appétit inchangé (42,9 % ; χ2 = 8,27, df = 1, p = 0,004). De même, un plus grand nombre de patients du groupe à appétit accru (19/24, 79,2 %) ont gagné plus de 10 % de leur poids corporel initial après 12 semaines par rapport aux patients du groupe à appétit inchangé (0,0 % ; χ2 = 14,32, df = 1, p < 0,001) (tableaux supplémentaires 3-5). Après un traitement de 12 semaines par l’olanzapine, 58,3 % des patients sont devenus en surpoids dans le groupe avec augmentation de l’appétit, contre 28,6 % des patients dans le groupe avec appétit inchangé. L’augmentation de l’appétit a fortement médié la prise de poids induite par l’olanzapine avec un effet médiateur de 66,2%.

Tableau 2 Statistiques descriptives des mesures de résultats entre les groupes appétit augmenté et appétit inchangé au départ, et aux semaines 4, 8 et 12.
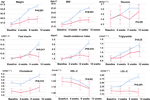
Figure 2 Comparaison du poids corporel, de l’IMC, du glucose et des taux de lipides entre les groupes à appétit accru et inchangé. La ligne bleue indique les patients dont l’appétit a augmenté ; la ligne rouge indique les patients dont l’appétit est resté inchangé.
Augmentation de l’appétit et perturbations métaboliques induites par l’olanzapine
On a observé des différences significatives en termes d’insuline (p = 0,017), d’indice de résistance à l’insuline (p = 0,015) et de LDL-C (p = 0,001) entre le groupe d’augmentation de l’appétit et le groupe inchangé après 12 semaines (figure 2 et tableau 2). Quatre patients du groupe augmentation de l’appétit avaient un cholestérol ≥ 5,18 mmolċl-1, neuf avaient des triglycérides ≥ 1,70 mmolċl-1, six avaient un HDL-C < 1,04ċmmol l-1, et trois avaient un LDL-C ≥ 3,37 mmolċl-1 à la semaine 12. Au total, 13/24 patients du groupe à appétit accru présentaient une dyslipidémie après 12 semaines, tandis qu’aucun des patients du groupe à appétit inchangé n’a développé de dyslipidémie pendant la période d’étude (tableau 3).

Tableau 3 Dyslipidémie définie par chaque mesure de résultat unique dans les groupes à appétit accru et inchangé.
Le pic de gain de poids atteint 1 mois après le mois d’augmentation de l’appétit
Dans le groupe appétit augmenté, nous avons analysé le gain de poids moyen pour chaque patient à quatre points de temps : avant le mois de temps d’augmentation de l’appétit (-1M), le mois de temps d’augmentation de l’appétit (0M), un mois après l’augmentation de l’appétit (+1M) et deux mois après l’augmentation de l’appétit (+2M). Par rapport au -1M, on a constaté une augmentation de la prise de poids au 0M, mais ce changement n’était pas significatif (-1M vs 0M, 1,4 ± 1,2 kg vs 3,1 ± 1,4 kg). La prise de poids a atteint un pic de croissance à +1M, avec un poids de 4,3 ± 2.Augmentation de 4 kg. La croissance pondérale a décéléré à +2M (p < 0,001) de 1,6 ± 1,5 kg. La prise de poids à +2M a ralenti et s’est stabilisée, et aucune différence significative n’a été observée par rapport à -1M (figure 3 et tableau supplémentaire 6).
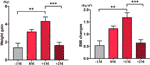
Figure 3 Vitesse moyenne de prise de poids dans le groupe appétit accru. La prise de poids moyenne de chaque patient par mois pendant la période d’étude a été analysée à quatre points de temps : avant le mois de temps d’augmentation de l’appétit (-1M), le mois de temps d’augmentation de l’appétit (0M), 1 mois après le mois de temps d’augmentation de l’appétit (+1M), et 2 mois après le mois de temps d’augmentation de l’appétit (+2M). ** indique P < 0,01, *** indique P < 0,001.
Une augmentation de l’appétit plus tôt prédit une prise de poids plus importante dans le mois suivant le mois d’augmentation de l’appétit
Nous avons ensuite comparé la vitesse de prise de poids des participants ayant augmenté leur appétit dans les 4 semaines (A) et des participants ayant augmenté leur appétit entre 4 et 8 semaines (B). A 0M, les vitesses de prise de poids entre les participants ayant augmenté leur appétit dans les 4 semaines et les participants ayant augmenté leur appétit entre 4 et 8 semaines n’étaient pas significativement différentes. Cependant, les participants ayant augmenté leur appétit plus tôt ont montré une vitesse de prise de poids significativement plus élevée à +1M. Ces résultats montrent qu’une augmentation précoce de l’appétit peut entraîner une prise de poids plus importante pendant la période de suivi (figure 4). Des changements similaires de l’IMC ont été observés au cours des quatre points temporels (figures 3 et 4).
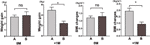
Figure 4 Comparaison de la vitesse de gain de poids des participants ayant augmenté leur appétit au cours des différents mois. Nous avons comparé la vitesse de prise de poids des participants dont l’appétit a augmenté dans les 4 semaines (A) et des participants dont l’appétit a augmenté entre 4 et 8 semaines (B) dans le mois du temps à l’appétit augmenté (0M) et 1 mois après le mois du temps à l’appétit augmenté (+1M). ns, indique non significatif, * indique P < 0,05.
Appétit et vitesse de changement des perturbations métaboliques
Les données descriptives détaillées des changements de poids, d’IMC, de glycémie à jeun, d’insuline, d’indice de résistance à l’insuline, de triglycérides, de cholestérol, de HDL-C et de LDL-C sont résumées dans le tableau 2. Pour étudier l’association entre l’augmentation de l’appétit et le métabolisme du glucose et des lipides, nous avons analysé les changements de ces indicateurs à quatre points de temps dans le groupe à appétit accru. Aucune modification significative de la vélocité n’a été observée pour le glucose, les triglycérides, le HDL-C et le LDL-C à aucun moment. Des augmentations significatives des vitesses de l’insuline et de l’indice de résistance à l’insuline n’ont été observées qu’à +2M (figure supplémentaire 1 et tableau supplémentaire 6). D’autres comparaisons ont suggéré que les participants ayant augmenté leur appétit dans les 4 semaines ne présentaient pas d’augmentation significative de la vitesse de l’insuline et de l’indice de résistance à l’insuline à 0M et +1M par rapport aux participants ayant augmenté leur appétit entre 4 et 8 semaines (figure supplémentaire 2).
La prédiction de l’appétit sur la prise de poids et les perturbations métaboliques induites par l’olanzapine
Nous avons effectué une analyse de régression linéaire pour évaluer l’effet de l’augmentation de l’appétit sur la prise de poids, la glycémie et les taux de lipides. Après avoir contrôlé les variables statistiquement significatives telles que le sexe, l’âge, la taille et la durée, nous avons inclus la prise de poids, l’IMC, la glycémie à jeun, l’insuline, l’indice de résistance à l’insuline, les triglycérides, le cholestérol, le HDL-C et le LDL-C comme variables dépendantes et l’appétit comme variable indépendante dans l’analyse de régression. L’augmentation de l’appétit était associée aux changements de poids (β = 0,67, p =0,0003), d’IMC (β = 0,63, p = 0,0004), d’insuline (β = 0,49, p = 0,019), d’indice de résistance à l’insuline (β = 0,51, p = 0,0149) et de LDL-C (β = 0.61, p = 0,0035) (tableau supplémentaire 7).
Des améliorations significatives du point de départ au point final des symptômes cliniques (évalués par PANSS, p < 0,001) ont été observées après le traitement par olanzapine. Aucune différence significative dans le PANSS n’a été observée entre les groupes à appétit accru et à appétit inchangé (p > 0,05).
Effets indésirables
Parmi les 31 patients qui ont terminé l’étude, neuf (29.0%) patients ont signalé une hypoactivité, huit (25,8%) patients ont signalé une somnolence, quatre (12,9%) patients ont eu un test hépatique anormal, deux (6,5%) patients ont signalé une akathisie, quatre (12,9%) patients ont eu une constipation, un (3.2%) patient a eu de la diarrhée, et deux (6,5%) patients se sont sentis étourdis, et 80,6% (25/31) patients ont augmenté leur poids corporel de plus de 7% pendant la période d’étude.
Discussion
Dans cette étude prospective, les principaux résultats ont montré que 77,4% des patients ont augmenté leur appétit après le traitement par l’olanzapine, et ces patients qui ont augmenté leur appétit ont pris plus de poids que les patients dont l’appétit est resté inchangé (9,1 kg contre 3,9 kg). De même, un plus grand nombre de patients du groupe ayant augmenté leur appétit ont augmenté leur poids corporel initial de plus de 7 ou 10 %, ce qui suggère que l’augmentation de l’appétit est associée à une prise de poids substantielle chez les patients naïfs en premier épisode de schizophrénie traités par olanzapine. De plus, l’analyse de régression linéaire a également confirmé que l’augmentation de l’appétit était fortement liée à la prise de poids induite par l’olanzapine. Ces résultats étaient conformes aux rapports précédents (Gothelf et al., 2002 ; Cope et al., 2005). Murashita et al. (2005) ont observé une augmentation des niveaux de ghréline stimulant l’appétit et du pourcentage de graisse corporelle chez des patients schizophrènes traités par olanzapine. Les résultats d’une étude randomisée en double aveugle suggèrent que l’olanzapine induit une envie de manger et une frénésie alimentaire dans une plus grande mesure que la clozapine (Murashita et al., 2005 ; Kluge et al., 2007). Des résultats similaires ont également été rapportés chez des souris traitées par l’olanzapine (Cope et al., 2005). L’action de l’olanzapine sur de multiples sites récepteurs, en particulier les récepteurs D2 et 5H3, qui modulent l’appétit, a également été appliquée dans le traitement de l’anorexie mentale et des nausées et vomissements induits par la chimiothérapie (Kluge et al., 2007 ; Tan et al., 2009 ; Kafantaris et al., 2011).
Nous avons également constaté que 70,8% des patients ont augmenté leur appétit dans les 4 premières semaines du traitement initial par olanzapine, avec une moyenne de 20,3 jours d’augmentation. Certains patients ont même augmenté leur appétit dès le troisième jour après le traitement à l’olanzapine. Il est intéressant de noter que les patients dont l’appétit a augmenté plus tôt dans le temps étaient susceptibles de prendre plus de poids que les patients dont l’appétit a augmenté plus tard dans le temps, et que la prise de poids a atteint son maximum un mois après l’augmentation de l’appétit. Bien qu’aucune différence significative n’ait été trouvée dans l’appétit induit par l’olanzapine entre les hommes et les femmes, les patients de sexe féminin étaient plus susceptibles de prendre du poids (P < 0,001). Par conséquent, l’appétit doit être considéré comme un indicateur permettant de prédire la prise de poids induite par l’olanzapine, en particulier chez les patientes. Dans les milieux cliniques, les médecins devraient accorder plus d’attention aux patients dont l’appétit augmente tôt après le traitement à l’olanzapine et devraient lancer un plan de prévention du poids.
Les patients traités à l’olanzapine ont présenté une augmentation de plus de 7 % du poids corporel initial, ce qui est conforme aux résultats précédents (Gothelf et al., 2002 ; Wu et al., 2008). En plus d’une prise de poids significative, les patients traités par olanzapine présentaient un métabolisme du glucose et des lipides significativement perturbé après 12 semaines, ce qui est cohérent avec les observations précédemment publiées chez les patients atteints de schizophrénie (Correll et al., 2011). Comparativement aux patients du groupe à appétit inchangé, le groupe à appétit accru présentait des anomalies lipidiques significatives. La glycémie à jeun n’était pas significativement différente entre les deux groupes. Les participants ayant un appétit accru précoce n’ont pas montré une augmentation de la vitesse de l’insuline et de l’indice de résistance à l’insuline dans les mois qui ont suivi l’augmentation de l’appétit. Il est possible que les niveaux de glucose soient indépendants de la prise de poids, car l’appétit n’a pas affecté les niveaux de glucose.
Les résultats négatifs sur la santé physique associés aux antipsychotiques, tels que la prise de poids, les perturbations métaboliques et la morbidité associée, sont reconnus depuis longtemps (Wu et al., 2016). Des études antérieures ont suggéré que l’appétit pouvait prédire la prise de poids et les effets métaboliques indésirables induits par l’olanzapine (Gothelf et al., 2002 ; Poyurovsky et al., 2007 ; Fountaine et al., 2010). À notre connaissance, il s’agit de la première étude à évaluer l’association entre l’appétit, la prise de poids et les perturbations métaboliques après un traitement par olanzapine chez des patients naïfs en premier épisode de schizophrénie. Certains résultats nous donnent plus de preuves sur la façon de choisir raisonnablement les médicaments dans le travail clinique et donnent plus d’avantages pour prévenir la prise de poids et les perturbations métaboliques induites par l’olanzapine.
Il y a plusieurs limites à notre étude. Premièrement, cette étude n’a pas mesuré l’apport alimentaire tel que les repas et les collations, bien que tous les patients inclus aient reçu le même menu alimentaire standardisé. Une consommation élevée de graisses et de fructose peut diminuer le contrôle de l’appétit en affectant la régulation centrale de l’appétit. En effet, les régimes riches en fructose ont des effets néfastes sur la signalisation centrale de l’appétit et la fonction cognitive (Lowette et al., 2015 ; Dalvi et al., 2017). Deuxièmement, nous n’avons pas examiné les niveaux de leptine et de ghréline pendant la période d’étude. Sécrétées respectivement par le tissu adipeux et l’estomac, la leptine et la ghréline jouent un rôle crucial dans la régulation de la prise alimentaire et du métabolisme énergétique (Cui et al., 2017). Plusieurs études ont constaté une augmentation du taux de leptine et une diminution du taux de ghréline au cours des premières semaines après l’initiation du traitement par olanzapine (Basoglu et al., 2010 ; Stip et al., 2012 ; Lu et al., 2015). L’augmentation du taux de leptine reste stable pendant plusieurs semaines, mais le taux de ghréline augmente sur une période plus longue (Sentissi et al., 2008). Des recherches supplémentaires devraient suivre les réponses de la leptine et de la ghréline à l’augmentation de l’appétit, ainsi que leurs relations avec les paramètres métaboliques et les effets cliniques. En outre, nous n’avons pas surveillé les niveaux d’activité pendant la période d’étude. Bien que certaines études aient rapporté que l’olanzapine augmentait le poids corporel uniquement en augmentant l’appétit et la prise alimentaire, sans différences significatives dans la dépense énergétique au repos (Gothelf et al., 2002 ; Fountaine et al., 2010). Un certain nombre d’études ont rapporté une réduction des activités physiques avec la prise d’olanzapine (Perez-Cruzado et al., 2018). Dans notre étude, 29,0 % des patients ont signalé une hypoactivité et 25,8 % des patients ont signalé une somnolence pendant la période de traitement par olanzapine de 12 semaines. Hillebrand et al. (2005) ont constaté que le traitement à l’olanzapine réduisait l’activité physique chez les rats exposés à une anorexie basée sur l’activité. Le traitement à l’olanzapine a également réduit le niveau d’activité de patients souffrant d’anorexie mentale, sans qu’il y ait de différences significatives en termes de poids corporel et de taux de leptine plasmatique par rapport aux patients non traités. Notre étude précédente a démontré que les interventions sur le mode de vie, qui comprenaient des programmes psychoéducatifs, diététiques et d’exercice, pouvaient réduire la prise de poids induite par les antipsychotiques (Wu et al., 2008). En outre, il serait préférable de comparer un plus grand nombre de patients avec des témoins sains d’âge similaire, ce qui peut aider à interpréter l’augmentation de l’appétit et les changements métaboliques induits par l’olanzapine sont spécifiquement liés à ses propriétés pharmacologiques. D’autres études devraient se concentrer sur les mécanismes de l’augmentation de l’appétit après un traitement à l’olanzapine (Koopmann et al., 2012 ; Sweeney et al., 2017 ; Mancuso et al., 2019). Le système de récompense dans les régions striatales pourrait être associé à la prise de poids associée aux antipsychotiques (Nielsen et al., 2016). L’altération de l’activité dans le cortex cingulaire antérieur subgénual peut également sous-tendre en partie l’augmentation de l’appétit après un traitement par olanzapine (Pawlowski et al., 2018). Des études d’imagerie devraient être réalisées pour étudier la modulation par l’olanzapine de l’activité cérébrale profonde liée à l’appétit.
Conclusions
En conclusion, notre étude a montré que l’appétit est lié à la prise de poids et à la dyslipidémie induites par l’olanzapine chez les patients schizophrènes en premier épisode naïfs de médicaments. L’évaluation des changements d’appétit est un moyen facile et pratique de prédire la prise de poids, ce qui donne aux cliniciens plus de temps et d’options pour les stratégies d’intervention. Les premières inventions diététiques visant à diminuer l’appétit et à réduire la prise alimentaire peuvent être utiles pour le contrôle du poids chez les patients schizophrènes traités par olanzapine.
Data Availability Statement
Les ensembles de données générés pour cette étude sont disponibles sur demande auprès de l’auteur correspondant.
Déclaration d’éthique
Cette étude a été réalisée conformément à la Déclaration d’Helsinki (Association G.A.o.t.W.M., 2013), et approuvée par le Comité d’éthique du deuxième hôpital Xiangya, Université centrale du Sud. Après une description complète de l’étude aux participants, un consentement éclairé a été obtenu avant la participation à l’étude.
Contributions des auteurs
JH a analysé et interprété les données des patients et a été un contributeur majeur à la rédaction du manuscrit. G-RH a principalement conçu et réalisé l’étude. YeY, C-CL, J-MX, Y-JL et X-JP ont participé au recrutement des patients, au contrôle de la qualité des données et à la documentation des effets indésirables liés au traitement. YiY a participé à la révision du manuscrit. J-PZ a guidé la conception de l’étude. RR-W était responsable du contenu général. Tous les auteurs ont lu et approuvé le manuscrit final.
Funding
Ce travail a été soutenu par les projets du programme clé de R&D, la Fondation nationale des sciences de Chine (subvention n° 2016YFC1306900) et la Fondation nationale des sciences naturelles de Chine (subvention n° 81622018. et n° 81901401).
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à souligner la précieuse contribution des participants et le soutien de leurs médecins généralistes. Nous tenons également à remercier plusieurs réviseurs anonymes pour leurs précieux commentaires et suggestions visant à améliorer la qualité de l’article.
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à : https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Supplément Figure 1 | Vélocité des changements de la glycémie et des lipides dans le groupe appétit accru. Les valeurs moyennes de changement pour chaque patient par mois pendant la période d’étude ont été analysées à quatre points de temps : avant le mois de temps à l’appétit accru (-1M), le mois de temps à l’appétit accru (0M), 1 mois après le mois de temps à l’augmentation de l’appétit (+1M), et 2 mois après le mois de temps à l’appétit accru (+2M).
Supplément Figure 2 | Comparaison des vitesses de changement de l’insuline et de l’indice de résistance à l’insuline des participants ayant un appétit accru dans différents mois. Nous avons comparé la vélocité des participants ayant une augmentation de l’appétit dans les 4 semaines (A) et des participants ayant une augmentation de l’appétit entre 4 et 8 semaines (B) dans le mois du temps d’augmentation de l’appétit (0M) et 1 mois après le mois du temps d’augmentation de l’appétit (+1M).
Tableau complémentaire 1 | Nombre de patients qui avaient augmenté le poids corporel initial de plus de 7 % ou 10 % aux semaines 4, 8 et 12.
Tableau complémentaire 2 | Nombre de patients qui avaient augmenté le poids corporel initial de plus de 7 % ou 10 % aux semaines 4, 8 et 12 chez les patients ayant un appétit accru.
Tableau complémentaire 3 | Nombre de patients ayant augmenté le poids corporel initial de plus de 7 % ou 10 % aux semaines 4, 8 et 12 chez les patients ayant un appétit inchangé.
Tableau complémentaire 4 | Comparaison des nombres de prise de poids de 7 % ou 10 % entre les patients ayant un appétit accru et les patients ayant un appétit inchangé aux semaines 4, 8 et 12.
Tableau complémentaire 5 | L’analyse de la vélocité de la prise de poids moyenne, du glucose et des changements lipidiques dans le groupe avec augmentation de l’appétit à quatre points dans le temps : avant le mois du temps de l’augmentation de l’appétit (-1M), le mois du temps de l’augmentation de l’appétit (0M), 1 mois après le mois du temps de l’augmentation de l’appétit (+1M) et 2 mois après le mois du temps de l’augmentation de l’appétit (+2M). ns indique non significatif, * indique une valeur p < 0,05, ** indique une valeur p < 0,01, *** indique une valeur p < 0,001.
Tableau complémentaire 6 | Estimations des effets de l’appétit sur le gain de poids et les mesures de résultats liés au métabolisme à partir d’un modèle mixte linéaire général tout en contrôlant l’âge, la durée de la maladie et le sexe.
Tableau complémentaire 7-1 | Les changements de poids, d’IMC, d’insuline, d’IRI et de LDL-C par patient pendant la période de traitement dans différents groupes.
Tableau complémentaire 7-2 | Estimations des effets de l’appétit sur la prise de poids et les mesures de résultats liés au métabolisme.
Abréviations
ASG, antipsychotiques de deuxième génération ; ECR, essai clinique randomisé ; CAFÉ, The Comparison of Atypicals for First Episode ; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness ; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition ; ECG, Electrocardiogramme ; PANSS, The Positive and Negative Syndrome Scale ; TESS, Treatment Emergent Symptom Scale ; ELISA, Enzyme-linked immunosorbent assays ; BMI, Body mass index ; HDL-C, High-density lipoprotein ; LDL-C, Low-density lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsychotic-induced weight gain : a comprehensive research synthesis. Am. J. Psychiatry 156, 1686-1696. doi : 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Manuel diagnostique et statistique des troubles mentaux (DSM-5®) (Arlington, VA : American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). Niveaux de ghréline, de cholécystokinine, de visfatine, de leptine et de protéine liée à l’agouti pendant un traitement de 6 semaines à l’olanzapine chez des patients masculins présentant un premier épisode de psychose. Int. Clin. Psychopharmacol. 25, 165-171. doi : 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). Le rôle potentiel de l’appétit dans la prédiction des changements de poids pendant le traitement avec l’olanzapine. BMC Psychiatry 10, 72. doi : 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsychotic drug-induced weight gain : development of an animal model. Int. J. Obes. 29, 607. doi : 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Risque cardiométabolique des médicaments antipsychotiques de deuxième génération lors de leur première utilisation chez les enfants et les adolescents. Jama 302, 1765-1773. doi : 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Les médicaments antipsychotiques et l’obésité. Trends Mol. Med. 17, 97-107. doi : 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). Les bases cellulaires et moléculaires de la résistance à la leptine et à la ghréline dans l’obésité. Nat. Rev. Endocrinol. 13, 338-351. doi : 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Les graisses élevées induisent une inflammation aiguë et chronique dans l’hypothalamus : effet du régime riche en graisses, du palmitate et du TNF-alpha sur les neurones NPY régulateurs de l’appétit. Int. J. Obes. (Lond) 41, 149-158. doi : 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Ethnicité et surmortalité dans les maladies mentales graves : une étude de cohorte. Lancet Psychiatry 4, 389-399. doi : 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Surmortalité en cas de maladie mentale grave : étude de cohorte basée sur la population sur 10 ans dans les zones rurales de l’Éthiopie. Br. J. Psychiatry 206, 289-296. doi : 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Augmentation de l’apport alimentaire et de la dépense énergétique après l’administration d’olanzapine à des hommes en bonne santé. Obesity 18, 1646-1651. doi : 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
Association G.A.o.t.W.M. (2013). Déclaration d’Helsinki de l’Association médicale mondiale : principes éthiques pour la recherche médicale impliquant des sujets humains. JAMA 10 (20) 2191-2194. doi : 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Prise de poids associée à une augmentation de la consommation alimentaire et à un faible niveau d’activité habituelle chez des adolescents schizophrènes hospitalisés traités à l’olanzapine. Am. J. Psychiatry 159, 1055-1057. doi : 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Mécanismes physiopathologiques du risque cardiométabolique accru chez les personnes atteintes de schizophrénie et d’autres maladies mentales graves. Lancet Psychiatry 2, 452-464. doi : 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). L’olanzapine réduit l’activité physique chez les rats exposés à l’anorexie basée sur l’activité : implications possibles pour le traitement de l’anorexie mentale ? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y.. (2017). Nouvelles directives et preuves pour la prévention et le traitement de la dyslipidémie et des maladies cardiovasculaires athérosclérotiques en Chine. Chronic Dis. Trans. Med. 3, 73. doi : 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Efficacité et tolérance comparatives de 32 antipsychotiques oraux pour le traitement aigu des adultes atteints de schizophrénie multi-épisode : une revue systématique et une méta-analyse en réseau. Lancet 394 (10202), 939-951. doi : 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Une étude pilote contrôlée par placebo de l’olanzapine adjuvante pour les adolescents souffrant d’anorexie mentale. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi : 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Méthodes dans l’obésité. Conn « s Current Therapy. Ed. Rakel, R. E. (Philadelphie : WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapine and olanzapine are associated with food craving and binge eating : results from a randomized double-blind study. J. Clin. Psychopharmacol. 27, 662-666. doi : 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). The association of the appetitive peptide acetylated ghrelin with alcohol craving in early abstinent alcohol dependent individuals. Psychoneuroendocrinologie 37, 980-986. doi : 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Médicaments antipsychotiques de deuxième génération contre ceux de première génération pour la schizophrénie : une méta-analyse. Lancet 373, 31-41. doi : 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Efficacité et tolérance comparatives de 15 médicaments antipsychotiques dans la schizophrénie : une méta-analyse à traitements multiples. Lancet 382, 951-962. doi : 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Efficacité des médicaments antipsychotiques chez les patients atteints de schizophrénie chronique. New Engl. J. Med. 353, 1209-1223. doi : 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Effets des régimes à haute teneur en fructose sur la signalisation centrale de l’appétit et la fonction cognitive. Front. Nutr. 2, 5. doi : 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Effets différentiels de l’olanzapine et de la clozapine sur les niveaux plasmatiques des adipocytokines et de la ghréline totale. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Les changements dans les hormones régulant l’appétit après la prise de nourriture sont associés à des changements dans l’appétit déclaré et une mesure de l’alimentation hédonique chez les filles et les jeunes femmes souffrant d’anorexie mentale. Psychoneuroendocrinologie 113, 104556. doi : 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Efficacité et tolérance de l’olanzapine, de la quétiapine et de la rispéridone dans le traitement de la psychose précoce : une comparaison randomisée en double aveugle sur 52 semaines. Am. J. Psychiatry 164, 1050-1060. doi : 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). L’olanzapine augmente le taux de ghréline plasmatique chez les patients atteints de schizophrénie. Psychoneuroendocrinologie 30, 106-110. doi : 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Le risque médical chez les patients atteints de troubles bipolaires et de schizophrénie. J. Clin. Psychiatry 67, e16. doi : 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Activité de récompense striatale et changement de poids associé aux antipsychotiques chez les patients atteints de schizophrénie sous traitement initial. JAMA Psychiatry 73, 121-128. doi : 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Enquête sur le mécanisme de l’augmentation de l’appétit après l’olanzapine par sLORETA pendant le sommeil. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Médicaments et activité physique et forme physique dans les maladies mentales graves. Psychiatry Res. 267, 19-24. doi : 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Attenuating effect of reboxetine on appetite and weight gain in olanzapine-treated schizophrenia patients : a double-blind placebo-controlled study. Psychopharmacologie 192, 441-448. doi : 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). A comparison of the effects of olanzapine and risperidone versus placebo on eating behaviors. J. Clin. Psychopharmacol. 25, 413-418. doi : 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Niveaux de leptine et de ghréline chez les patients atteints de schizophrénie au cours de différents traitements antipsychotiques : une revue. Schizophr. Bull. 34, 1189-1199. doi : 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Changements neuronaux associés au traitement de l’information sur l’appétit chez les patients schizophrènes après 16 semaines de traitement à l’olanzapine. Transl. Psychiatry 2, e128. doi : 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Rôle de suppression de l’appétit des neurones glutamatergiques septaux médians. Proc. Natl. Acad. Sci. 114, 13816-13821. doi : 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Recherche clinique de l’Olanzapine pour la prévention des nausées et vomissements induits par la chimiothérapie. J. Exp. Clin. Cancer Res. 28, 131. doi : 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Lifestyle intervention and metformin for treatment of antipsychotic-induced weight gain : a randomized controlled trial. Jama 299, 185-193. doi : 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Traitement par la metformine de la dyslipidémie induite par les antipsychotiques : une analyse de deux essais randomisés et contrôlés par placebo. Mol. Psychiatry 21, 1537. doi : 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar
.




