Inhibition d’une enzyme
Les enzymes sont nécessaires à la plupart, sinon à tous, les processus nécessaires à la vie. Les enzymes catalysent une réaction en réduisant l’énergie d’activation nécessaire pour que la réaction se produise. Cependant, les enzymes doivent être étroitement régulées pour s’assurer que les niveaux du produit n’augmentent pas à des niveaux non désirés. Ceci est accompli par l’inhibition des enzymes.
Types d’inhibition
Les inhibiteurs réversibles et irréversibles sont des produits chimiques qui se lient à une enzyme pour supprimer son activité. Une méthode pour y parvenir est de se lier de façon quasi permanente à une enzyme. Ces types d’inhibiteurs sont dits irréversibles. Cependant, d’autres produits chimiques peuvent se lier de manière transitoire à une enzyme. Ils sont dits réversibles. Les inhibiteurs réversibles se lient soit à un site actif (inhibiteurs compétitifs), soit à un autre site sur l’enzyme (inhibiteurs non compétitifs).
 Fig 1 – Diagramme pour montrer l’effet des inhibiteurs enzymatiques compétitifs et non compétitifs.
Fig 1 – Diagramme pour montrer l’effet des inhibiteurs enzymatiques compétitifs et non compétitifs.Inhibiteurs compétitifs
Les inhibiteurs compétitifs entrent en compétition avec le substrat au niveau du site actif, et augmentent donc le Km (la constante de Michaelis-Menten). Cependant, le Vmax reste inchangé car, avec une concentration suffisante de substrat, la réaction peut encore se terminer. Le tracé du graphique de l’activité enzymatique en fonction de la concentration de substrat serait décalé vers la droite en raison de l’augmentation du Km, tandis que le tracé de Lineweaver-Burke serait plus raide par rapport à l’absence d’inhibiteur.
Inhibiteurs non compétitifs
Les inhibiteurs non compétitifs se lient à un autre emplacement sur l’enzyme et, de ce fait, diminuent le VMAX. Cependant, le KM reste inchangé. Cela est démontré par un maximum plus faible sur un graphique représentant l’activité de l’enzyme en fonction de la concentration en substrat et un ordonnée à l’origine plus élevé sur un graphique de Lineweaver-Burke, par rapport à l’absence d’inhibiteur.
| Compétitif | Non compétitif | |
| Où agit-il ? | Site actif | Site alternatif |
| Changement de Km | Augmentation | Inchangé |
| Changement de Vmax | Inchangé | Diminution |
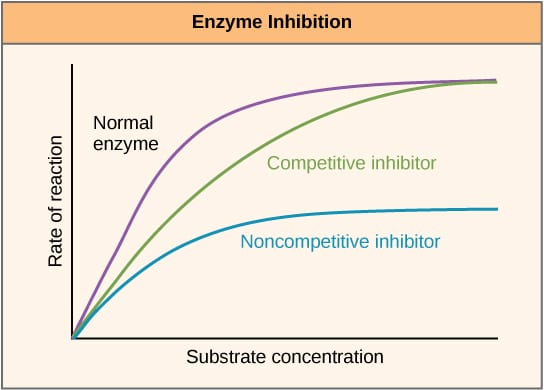 Fig 2 – Diagramme permettant de montrer l’effet des inhibiteurs d’enzymes sur la vitesse de réaction et sa variation en fonction de la concentration du substrat.
Fig 2 – Diagramme permettant de montrer l’effet des inhibiteurs d’enzymes sur la vitesse de réaction et sa variation en fonction de la concentration du substrat.Inhibition allostérique
Les enzymes allostériques affichent une courbe sigmoïdale contrairement à la courbe hyperbolique affichée par les enzymes de Michaelis-Menten. Ceci est dû au fait que la plupart des enzymes allostériques contiennent plusieurs sous-unités qui peuvent s’affecter mutuellement lorsque le substrat se lie à l’enzyme. L’inhibition peut affecter soit K0,5, qui est la concentration de substrat pour la demi-saturation, soit Vmax, soit les deux. Il en résulte un déplacement de la courbe vers la droite, et dans le cas d’une réduction de Vmax, un déplacement de la courbe vers le bas.
Les enzymes allostériques ont deux états : un état de faible affinité surnommé l’état « T » et l’état « R » de forte affinité. Les inhibiteurs agissent en se liant préférentiellement à l’état T d’une enzyme allostérique, ce qui amène l’enzyme à maintenir cet état de faible affinité.
Ceci est extrêmement utile pour limiter la quantité de produit d’une enzyme, car le produit peut ensuite aller inhiber le même type d’enzyme pour s’assurer que la quantité de produit n’est pas excessive. C’est ce qu’on appelle l’inhibition par rétroaction. Par exemple, l’ATP inhibe de manière allostérique la pyruvate kinase pour empêcher une formation accrue de pyruvate, de sorte que moins d’ATP est finalement formé. De plus, la phosphofructokinase est inhibée de manière allostérique par le citrate, un intermédiaire du cycle de Kreb. Cela signifie que la glycolyse sera limitée lorsqu’il y a une forte génération d’ATP à partir du cycle de Kreb.
 Fig 3 – Diagramme pour montrer le mécanisme de l’inhibition et de l’activation allostérique.
Fig 3 – Diagramme pour montrer le mécanisme de l’inhibition et de l’activation allostérique.Phosphorylation
La phosphorylation fournit un autre mécanisme par lequel les enzymes peuvent être inhibées. Cela se produit généralement par l’action des enzymes kinases, qui peuvent soit inhiber soit activer une enzyme selon la situation. Les enzymes kinases séparent un groupe phosphate de l’ATP et le lient à l’enzyme. Dans les situations où cela entraîne une augmentation de l’activité enzymatique, cela crée une réaction en cascade, permettant de générer une grande réponse à partir d’un petit stimulus.
Zymogènes
Les enzymes peuvent également être sécrétées dans un état inactif, qui sont appelés zymogènes. Les zymogènes sont un mécanisme utile qui permet aux enzymes d’être transportées en toute sécurité vers différents endroits, sans que l’enzyme ne devienne active et ne remplisse sa fonction en cours de route. Ils restent inactifs en raison d’une addition d’acides aminés dans la protéine. Par conséquent, pour activer un zymogène, une autre enzyme doit cliver ces acides aminés supplémentaires. Par exemple, le chymotrypsinogène est synthétisé par le pancréas, mais il est inactivé et ne peut pas fonctionner. En voyageant vers les intestins, une autre enzyme (trypsine) clive les acides aminés supplémentaires pour produire la forme activée, la chymotripsine.
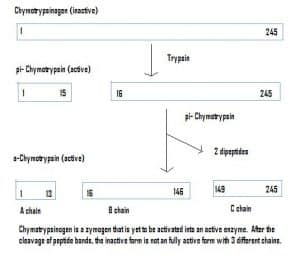 Fig 4 – Diagramme pour montrer l’activation du chymotrypsinogène dans le système gastro-intestinal et les enzymes impliquées à chaque étape.
Fig 4 – Diagramme pour montrer l’activation du chymotrypsinogène dans le système gastro-intestinal et les enzymes impliquées à chaque étape.Pertinence clinique – Pharmacocinétique
L’utilisation clinique la plus importante de l’inhibition enzymatique est l’utilisation de médicaments pharmaceutiques. Les inhibiteurs de l’ECA sont un traitement courant de l’hypertension. L’angiotensine I est convertie en angiotensine II par l’action de l’enzyme de conversion de l’angiotensine (ECA). Or, l’angiotensine II provoque de nombreux effets liés à une augmentation de la pression artérielle. Par conséquent, les inhibiteurs de l’ECA ont été conçus pour inhiber de manière compétitive l’action de l’ECA, ce qui entraîne une moindre formation d’angiotensine II et une baisse de la pression artérielle.
Alternativement, la pénicilline se lie de manière irréversible au site actif d’une enzyme appelée DD-transpeptidase. La DD-transpeptidase est responsable de l’étape finale de la synthèse de la paroi cellulaire bactérienne. En inhibant cette enzyme, la bactérie ne peut pas synthétiser une paroi cellulaire et ne peut donc pas maintenir la vie.
Enfin, le cyanure est un exemple d’inhibiteur non compétitif. Le cyanure se lie à l’enzyme finale de la chaîne de transport d’électrons, et empêche cette enzyme de catalyser la réaction de l’oxygène à l’eau. Cela empêche le flux d’électrons dans la chaîne de transport d’électrons et aucun ATP ne peut être généré, ce qui entraîne la mort.




