L’hémoglobine et sa mesure
Le fonctionnement normal des cellules dépend d’un apport continu d’oxygène. Lorsque l’oxygène est consommé au cours du métabolisme cellulaire, du dioxyde de carbone est produit.
Une des principales fonctions du sang est l’acheminement de l’oxygène (O2), présent dans l’air inspiré, des poumons vers chaque cellule du corps et l’acheminement du dioxyde de carbone (CO2) des cellules vers les poumons, pour son élimination du corps dans l’air expiré.
Ces fonctions vitales de transport des gaz dépendent de la protéine hémoglobine contenue dans les érythrocytes (globules rouges). Chacun des 5 × 1010 érythrocytes normalement présents dans 1 ml de sang contient environ 280 millions de molécules d’hémoglobine.
1. STRUCTURE ET FONCTION DE L’HÉMOGLOBINE
La molécule d’hémoglobine (Hb) est grossièrement sphérique et comprend deux paires de sous-unités dissemblables (FIGURE 1).
Chacune des sous-unités est une chaîne polypeptidique pliée (la partie globine) à laquelle est attaché un groupe hème (dérivé de la porphyrine).
Au centre de chaque groupe hème se trouve un seul atome de fer à l’état ferreux (Fe2+). L’hème est donc une métallo-porphyrine, incidemment responsable de la couleur rouge du sang.
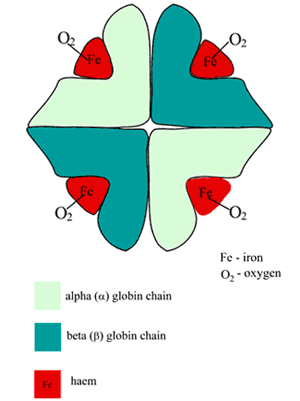
FIGURE 1 : Schéma de la structure de l’hémoglobine oxygénée (HbA)
Le site de fixation de l’oxygène de l’Hb est la poche d’hème présente dans chacune des quatre chaînes polypeptidiques ; un seul atome d’oxygène forme une liaison réversible avec le fer ferreux à chacun de ces sites, ainsi une molécule d’Hb fixe quatre molécules d’oxygène ; le produit est l’oxyhémoglobine (O2Hb).
La fonction de délivrance d’oxygène de l’Hb, c’est-à-dire sa capacité à « capter » l’oxygène au niveau des poumons et à le « libérer » vers les cellules des tissus est rendue possible par d’infimes changements de conformation de la structure quaternaire qui se produisent dans la molécule d’hémoglobine et qui modifient l’affinité de la poche de l’hème pour l’oxygène. L’Hb possède deux états structurels quaternaires : l’état désoxy (faible affinité pour l’oxygène) et l’état oxy (forte affinité pour l’oxygène).
Une série de facteurs environnementaux déterminent l’état quaternaire de l’Hb et donc son affinité relative pour l’oxygène. Le microenvironnement dans les poumons favorise l’état oxy-quaternaire, et donc l’Hb a une haute affinité pour l’oxygène ici.
A l’inverse, le microenvironnement des tissus induit le changement de conformation de la structure de l’Hb qui réduit son affinité pour l’oxygène, permettant ainsi la libération de l’oxygène vers les cellules tissulaires.
1.1. L’HÉMOGLOBINE ET L’ÉLIMINATION DU DIOXYDE DE CARBONE
Une petite quantité (jusqu’à 20 %) de CO2 est transportée des tissus vers les poumons, faiblement liée à l’acide aminé N-terminal des quatre unités polypeptidiques de globine de l’hémoglobine ; le produit de cette combinaison est la carbaminohémoglobine. Cependant, la plupart du CO2 est transporté sous forme de bicarbonate dans le plasma sanguin.
La conversion érythrocytaire du CO2 en bicarbonate, nécessaire à ce mode de transport du CO2, entraîne la production d’ions hydrogène (H+). Ces ions hydrogène sont tamponnés par l’hémoglobine désoxygénée.
Le rôle de l’hémoglobine dans le transport de l’oxygène et du dioxyde de carbone est résumé dans les FIGURES 2a et 2b.
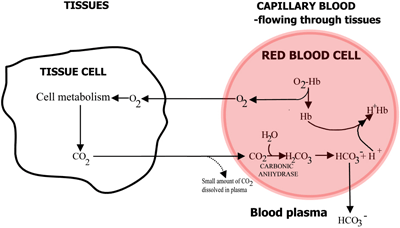
FIGURE 2a : TISSUS L’O2 diffuse du sang vers les tissus, le CO2 diffuse des tissus vers le sang
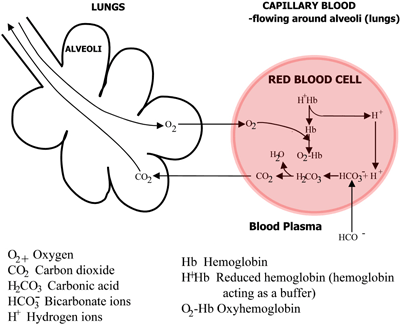
FIGURE 2b : LES POUMONS Le CO2 diffuse du sang vers les poumons, l’O2 diffuse des poumons vers le sang
Dans le sang capillaire qui circule dans les tissus, l’oxygène est libéré de l’hémoglobine et passe dans les cellules des tissus. Le dioxyde de carbone diffuse hors des cellules tissulaires dans les érythrocytes, où l’enzyme anhydrase carbonique des globules rouges permet sa réaction avec l’eau pour former de l’acide carbonique.
L’acide carbonique se dissocie en bicarbonate (qui passe dans le plasma sanguin) et en ions hydrogène, qui se combinent avec l’hémoglobine désormais désoxygénée. Le sang s’écoule vers les poumons, et dans les capillaires des alvéoles pulmonaires, les voies ci-dessus sont inversées. Le bicarbonate entre dans les érythrocytes et se combine ici avec les ions hydrogène, libérés par l’hémoglobine, pour former de l’acide carbonique.
Ce dernier se dissocie en dioxyde de carbone et en eau. Le dioxyde de carbone diffuse du sang vers les alvéoles des poumons et est éliminé dans l’air expiré. Pendant ce temps, l’oxygène diffuse des alvéoles vers le sang capillaire et se combine avec l’hémoglobine.
1.2. HÉMOGLOBINE NE POUVANT PAS LIER L’OXYGÈNE
Bien que normalement présentes à l’état de traces, il existe trois espèces d’hémoglobine : la méthémoglobine (MetHb ou Hi), la sulfhémoglobine (SHb) et la carboxyhémoglobine (COHb) qui ne peuvent pas lier l’oxygène.
Elles sont donc fonctionnellement déficientes, et des quantités accrues de l’une ou l’autre de ces espèces d’hémoglobine, généralement le résultat d’une exposition à des médicaments spécifiques ou à des toxines environnementales, peuvent compromettre sérieusement l’apport d’oxygène.
Un compte rendu complet de la structure et de la fonction de l’hémoglobine est fourni en référence .
ctHb, la concentration totale d’hémoglobine est typiquement définie comme la somme de l’hémoglobine oxygénée, de l’hémoglobine désoxygénée, de la carboxyhémoglobine et de la méthémoglobine.
Utilité clinique de la mesure de la ctHb
La raison principale de la mesure de la ctHb est la détection de l’anémie et l’évaluation de sa sévérité.
L’anémie peut être définie comme une réduction de la capacité de transport d’oxygène du sang due à une réduction du nombre d’érythrocytes et/ou à une réduction de la ctHb, de sorte que l’anémie est établie si la ctHb est inférieure à la limite inférieure de la plage de référence (normale) (TABLEAU I). Plus la ctHb est basse, plus l’anémie est sévère.
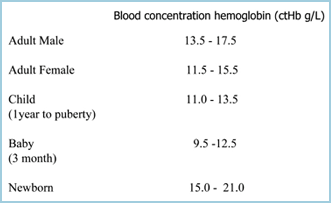
TABLEAU I : plages de référence de la ctHb (Réf 2)
L’anémie n’est pas une entité pathologique, plutôt une conséquence ou un signe de la maladie. La raison pour laquelle la ctHb est un test sanguin si fréquemment demandé est que l’anémie est une caractéristique d’une série de pathologies, dont beaucoup sont relativement communes (tableau II).
Les symptômes courants, dont la plupart sont non spécifiques, comprennent : pâleur, fatigue et léthargie, essoufflement – en particulier à l’effort, vertiges et évanouissements, maux de tête, constipation et augmentation du pouls, palpitations, tachycardie.

TABLEAU II : Quelques-uns des états cliniques associés à l’anémie
L’absence de ces symptômes n’exclut pas l’anémie ; de nombreuses personnes légèrement anémiques restent asymptomatiques, en particulier si l’anémie s’est développée lentement.
2.2. POLYCYTHEMIE
Alors que l’anémie est caractérisée par une ctHb réduite, une ctHb élevée indique une polycythémie. La polyglobulie survient en réponse à toute condition physiologique ou pathologique dans laquelle le sang contient moins d’oxygène que la normale (hypoxémie).
La réponse de l’organisme à l’hypoxémie comprend une augmentation de la production d’érythrocytes pour augmenter l’apport d’oxygène, et en conséquence la ctHb est élevée. Cette polyglobulie dite secondaire fait partie de l’adaptation physiologique à la haute altitude et peut être une caractéristique des maladies pulmonaires chroniques.
La polyglobulie primaire est une tumeur maligne beaucoup moins fréquente de la moelle osseuse appelée polyglobulie vera, qui se caractérise par une production incontrôlée de toutes les cellules sanguines, y compris les érythrocytes. La polycythémie, qu’elle soit secondaire ou primaire, est généralement beaucoup moins fréquente que l’anémie.
3.1. PERSPECTIVE HISTORIQUE
Le premier test clinique de mesure de l’Hb conçu il y a plus d’un siècle consistait à ajouter des gouttes d’eau distillée à un volume de sang mesuré jusqu’à ce que sa couleur corresponde à celle d’un standard coloré artificiel.
Une modification ultérieure consistait à saturer d’abord le sang avec du gaz de charbon (monoxyde de carbone) pour convertir l’hémoglobine en carboxyhémoglobine, plus stable. L’hémoglobinométrie moderne date des années 1950, après le développement de la spectrophotométrie et de la méthode de l’hémiglobincyanide (cynaméthemoglobine).
L’adaptation de cette méthode et d’autres pour une utilisation dans des analyseurs d’hématologie automatisés a suivi. Au cours des deux dernières décennies, les progrès se sont concentrés sur le développement de méthodes qui permettent le test au point de service (POCT) de l’hémoglobine.
Cette section traite d’abord de l’examen de certaines des méthodes actuellement utilisées dans le laboratoire, puis des méthodes POCT utilisées en dehors du laboratoire.
3.2. HEMIGLOBINCYANIDE – UNE MÉTHODE SPECTROPHOTOMÉTRIQUE
Près de 40 ans après avoir été adopté pour la première fois comme méthode de référence pour la mesure de l’hémoglobine par le Comité international de normalisation en hématologie (ICSH) , le test à l’hémiglobincyanide (HiCN) reste la méthode recommandée par l’ICSH par rapport à laquelle toutes les nouvelles méthodes de ctHb sont jugées et normalisées.
La considération détaillée qui suit reflète son importance continue à la fois comme méthode de référence et de routine de laboratoire.
3.2.1. Principe du test
Le sang est dilué dans une solution contenant du ferricyanure de potassium et du cyanure de potassium. Le ferricyanure de potassium oxyde le fer de l’hème à l’état ferrique pour former de la méthémoglobine, qui est convertie en hémiglobincyanure (HiCN) par le cyanure de potassium.
L’HiCN est un produit coloré stable, qui en solution présente un maximum d’absorbance à 540 nm et obéit strictement à la loi de Beer-Lambert. L’absorbance de l’échantillon dilué à 540 nm est comparée à l’absorbance à la même longueur d’onde d’une solution standard de HiCN dont la concentration équivalente en hémoglobine est connue.
La plupart des dérivés de l’hémoglobine (oxyhémoglobine, méthémoglobine et carboxyhémoglobine, mais pas la sulfhémoglobine) sont convertis en HiCN et donc mesurés par cette méthode.
3.2.1.1. Diluant pour réactifs (solution de Drabkin modifiée)
| Ferricyanure de potassium (K3Fe(CN)6) | 200 mg |
| Cyanure de potassium (KCN) | 50 mg |
| Phosphate de potassium dihydrogène (KH2 PO4) | 140 mg |
| Détergent non ionique (par ex.ionique (par ex.ex. Triton X-100) | 1 mL |
| Ceci est dilué à 1000 mL dans de l’eau distillée |
3.2.1.2. Méthode manuelle
25 µl de sang sont ajoutés à 5,0 ml de réactif, mélangés et laissés pendant 3 minutes. L’absorbance est lue à 540 nm par rapport à un blanc de réactif. L’absorbance de l’étalon HiCN est mesurée de la même manière.
3.2.1.3. ICSH HiCN standard
Le principal avantage de cette méthode est qu’il existe une solution standard de HiCN fabriquée et à laquelle est attribuée une valeur de concentration selon des critères très précis fixés et revus périodiquement par le Conseil international de normalisation en hématologie (ICSH) .
Cette solution standard internationale est le principal calibrant des solutions standard commerciales utilisées dans les laboratoires cliniques du monde entier. Ainsi, tous ceux qui utilisent la normalisation HiCN utilisent effectivement le même standard, dont la valeur a été scrupuleusement validée.
3.2.1.4. Interférences
La turbidité due aux protéines, aux lipides et aux matières cellulaires est un problème potentiel pour l’estimation spectrophotométrique de tout constituant du sang, y compris l’hémoglobine.
La grande dilution (1:251) de l’échantillon élimine largement le problème, mais des résultats de ctHb faussement élevés peuvent se produire chez les patients dont la concentration en protéines plasmatiques est particulièrement élevée .
Les échantillons fortement lipémiques et ceux contenant un nombre très élevé de globules blancs (leucocytes) peuvent également augmenter artefactuellement la ctHb par un mécanisme similaire .
3.2.1.5. Avantages de HiCN
- Norme internationale – précise
- Facilement adaptable aux analyseurs hématologiques automatisés ; donc reproductible (faible SD et CV – CV à l’intérieur du lot typiquement
- Bien établi et étudié en profondeur – recommandé par la CICS
- Réactif peu coûteux
3.2.1.6. Inconvénients du HiCN
- Méthode manuelle nécessitant un pipetage précis et un spectrophotomètre
- Réactif (cyanure) dangereux
- Ce qui précède limite son utilisation en dehors du laboratoire
- Sujet à l’interférence des lipides élevés, des protéines plasmatiques et du nombre de leucocytes
- Ne distingue pas les dérivés de l’hémoglobine qui n’ont pas de capacité de transport de l’oxygène (MetHb, COHb, SHb). Peut donc surestimer la capacité de transport d’oxygène du sang si ceux-ci sont présents en quantités anormales (plus que des traces).
3.3. MÉTHODES DE LABORATOIRE ALTERNATIVES (SANS CYANURES)
Le lauryl sulfate de sodium (SLS) est un tensioactif qui à la fois lyse les érythrocytes et forme rapidement un complexe avec l’hémoglobine libérée. Le produit SLS-MetHb est stable pendant quelques heures et présente un spectre caractéristique avec une absorbance maximale à 539 nm .
Le complexe obéit à la loi de Beer-Lambert, il y a donc une corrélation linéaire précise entre la concentration en Hb et l’absorbance du SLS-MetHb.
La méthode consiste simplement à mélanger 25 µL de sang avec 5,0 mL d’une solution de 2,08-mmol/L de SLS (tamponnée à un pH de 7,2), et à lire l’absorbance à 539 nm. Il a été démontré que les résultats de la ctHb par la méthode SLS-Hb présentent une corrélation très étroite (r = 0,998) avec la méthode HiCN de référence .
La méthode a été adaptée aux analyseurs d’hématologie automatisés et est aussi fiable en termes d’exactitude et de précision que les méthodes HiCN automatisées . Un avantage majeur est que le réactif est non-toxique. Il est également moins susceptible d’être perturbé par la lipémie et la concentration accrue de leucocytes .
L’instabilité à long terme du SDS-MetHb empêche son utilisation comme standard, de sorte que la méthode doit être calibrée avec du sang dont la ctHb a été déterminée par la méthode HiCN de référence.
3.3.2. Méthode à l’azide-méthémoglobine
Cette méthode est basée sur la conversion de l’hémoglobine en un produit coloré stable, l’azide-méthémoglobine, qui a un spectre d’absorbance presque identique à celui du HiCN .
Le réactif utilisé dans cette méthode est très similaire à celui utilisé dans la méthode de référence HiCN avec une substitution de l’azide de sodium pour le cyanure de potassium plus toxique. Comme dans la méthode HiCN, l’hémoglobine est convertie en méthémoglobine par le ferricyanure de potassium ; l’azide forme ensuite un complexe avec la méthémoglobine.
Les résultats de l’Hbc par cette méthode sont comparables aux résultats obtenus par la méthode HiCN de référence ; il s’agit d’une méthode manuelle alternative acceptable. Le potentiel explosif de l’azide de sodium empêche toutefois son utilisation sur les analyseurs d’hématologie automatisés . La réaction azide-MetHb a été adaptée aux hémoglobinomètres POCT.
3.4. MESURE DE LA ctHb HORS DU LABORATOIRE
Les méthodes de POCT considérées ici sont :
- Hémoglobinomètres portables
- CO-oximétrie – une méthode utilisée dans les analyseurs de gaz du sang POCT
- Échelle de couleur de l’OMS
3.4.1. Hémoglobinomètres portables
Les hémoglobinomètres portables comme l’HemoCue-B permettent une détermination précise de l’hémoglobine au chevet du patient. Ce sont essentiellement des photomètres qui permettent de mesurer l’intensité de la couleur des solutions.
La microcuvette jetable dans laquelle ces mesures sont effectuées sert également de récipient de réaction. Les réactifs nécessaires à la fois à la libération de l’Hb des érythrocytes et à la conversion de l’Hb en un produit coloré stable sont présents sous forme séchée sur les parois de la cuvette.
Il suffit d’introduire un petit échantillon (généralement 10 µL) de sang capillaire, veineux ou artériel dans la microcuvette et d’insérer la microcuvette dans l’instrument.
L’instrument est précalibré en usine en utilisant la norme HiCN, et l’absorbance de la solution de test est automatiquement convertie en ctHb. Le résultat est affiché en moins d’une minute.
3.4.1.1. Les avantages des hémoglobinomètres modernes comprennent
- Portabilité
- Fonctionnement sur batterie ou sur secteur, peuvent être utilisés n’importe où
- Petit volume d’échantillon (10 µL) obtenu par piqûre au doigt
- Rapide (résultat en 60 secondes)
- Facilité d’utilisation – pas de pipetage
- Formation minimale requise par le personnel non-laboratoire
- Normalisation par rapport au HiCN – résultats comparables à ceux obtenus en laboratoire
- Correction de la turbidité. A cet égard, les hémoglobinomètres portables sont supérieurs à la plupart des méthodes de ctHb .
Cette technologie a été largement évaluée dans une série de contextes et la plupart des études ont confirmé une exactitude et une précision acceptables par rapport aux méthodes de laboratoire.
3.4.1.2. Inconvénients
Certaines études , cependant, ont soulevé la préoccupation que dans les mains du personnel non-laboratoire les résultats peuvent être moins satisfaisants. Malgré la simplicité de leur fonctionnement, ces instruments ne sont pas à l’abri d’une erreur de l’opérateur, et une formation efficace est essentielle.
Il existe des preuves suggérant que les résultats dérivés d’échantillons capillaires (piqûre au doigt) sont moins précis que ceux dérivés d’échantillons capillaires ou veineux bien mélangés recueillis dans des flacons EDTA .
3.4.2. CO-oxymétrie
Un CO-oxymètre est un spectrophotomètre spécialisé, dont le nom reflète l’application originale, qui était de mesurer le COHb et le MetHb.
De nombreux analyseurs modernes de gaz du sang ont un CO-oximètre incorporé, permettant l’estimation simultanée de la ctHb pendant l’analyse des gaz du sang.
La mesure de la ctHb par CO-oximétrie est basée sur le fait que l’hémoglobine et tous ses dérivés sont des protéines colorées qui absorbent la lumière à des longueurs d’onde spécifiques et ont donc un spectre d’absorption caractéristique (FIGURE 3).
La loi de Beer-Lambert stipule que l’absorbance d’un seul composé est proportionnelle à la concentration de ce composé. Si la caractéristique spectrale de chaque substance absorbante dans une solution est connue, les lectures d’absorbance de la solution à plusieurs longueurs d’onde peuvent être utilisées pour calculer la concentration de chaque substance absorbante.
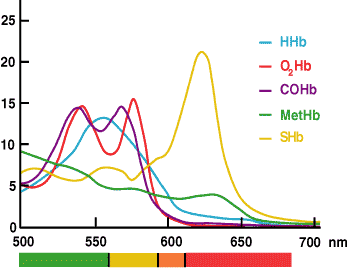
FIGURE 3.
Dans le CO-oxymètre, les mesures d’absorbance d’un échantillon de sang hémolysé à plusieurs longueurs d’onde dans la plage où les espèces d’hémoglobine absorbent la lumière (520-620 nm) sont utilisées par le logiciel installé pour calculer la concentration de chacun des dérivés de l’hémoglobine (HHb, O2Hb, MetHb et COHb). La ctHb est la somme calculée de ces dérivés.
Tout ce qui est demandé à l’opérateur est l’injection d’un échantillon de sang artériel bien mélangé dans l’analyseur de gaz du sang/CO-oxymètre.
L’échantillon, ou une partie de celui-ci, est automatiquement pompé vers la cuvette de mesure de l’oxymètre de CO, où – par une action chimique ou physique – les érythrocytes sont lysés pour libérer l’hémoglobine, qui est analysée par spectroscopie comme décrit ci-dessus.
Les résultats sont affichés avec les résultats des gaz du sang en une minute ou deux.
Plusieurs études ont confirmé que les résultats de la ctHb obtenus par oxymétrie de CO ne sont pas cliniquement significativement différents de ceux dérivés des méthodes de laboratoire de référence. La CO-oxymétrie constitue un moyen acceptable d’estimation urgente de la ctHb dans un contexte de soins intensifs.
3.4.2.1. Les avantages particuliers de la ctHb par oxymétrie de CO comprennent
- Vitesse d’analyse
- Facilité d’analyse
- Petit volume d’échantillon
- Aucun coût d’investissement ou de consommation au-delà de celui requis pour l’analyse des gaz du sang
- Paramètres supplémentaires (MetHb, COHb, O2Hb) mesurés
- Non affectés par un taux élevé de globules blancs
3.4.3. Échelle de couleur de l’hémoglobine de l’OMS (HCS)
Développé pour l’Organisation mondiale de la santé (OMS), ce test de faible technologie a une application limitée dans les pays développés mais a une énorme signification pour les pays économiquement défavorisés du monde en développement, où l’anémie est la plus répandue.
Dans les régions où il n’y a pas de laboratoire et où les ressources sont insuffisantes pour financer des hémoglobinomètres POCT plus sophistiqués, c’est pratiquement le seul moyen de déterminer la ctHb.
Le test HCS repose sur le principe simple que la couleur du sang est fonction de la ctHb. Une goutte de sang est absorbée sur du papier et sa couleur est comparée à un tableau de six nuances de rouge, chaque nuance représentant une ctHb équivalente : la plus claire 40 g/L et la plus sombre 140 g/L. Bien qu’en principe très simple, une recherche et une technologie considérables ont été utilisées dans le développement pour assurer la plus grande exactitude et précision possible .
Par exemple, des essais approfondis de différents papiers ont informé le choix final du papier pour la matrice des bandes de test, et l’analyse spectrophotométrique du sang et des mélanges de colorants a été employée pour arriver à la correspondance la plus proche possible entre la couleur de la carte et la couleur du sang à chaque ctHb de référence.
3.4.3.1. Avantages du test HCS
- Est facile à utiliser – ne nécessite qu’une formation de 30 minutes
- Ne nécessite aucun équipement ou puissance
- Est rapide – résultat en 1 minute
- Ne nécessite qu’un échantillon par piqûre de doigt (capillaire)
- Est très bon marché (environ 0,12 USD par test)
3.4.3.2. Inconvénients du test HCS
La fiabilité des résultats dépend du respect strict des instructions du test .
Les erreurs courantes comprennent :
- Une quantité inadéquate ou excessive de sang sur la bandelette réactive
- La lecture du résultat trop tardive (au-delà de 2 minutes) ou trop précoce (moins de 30 sceondes)
- La lecture du résultat dans de mauvaises conditions d’éclairage
Le test HSC a clairement des limites inhérentes . Au mieux, il peut déterminer que la ctHb d’un échantillon de patient se situe dans l’une des six plages de concentration suivantes : 30-50 g/L, 50-70 g/L, 70-90 g/L, 90-110 g/L, 110-130 g/L ou 130-150 g/L. Cela est tout de même théoriquement suffisant pour identifier tous les patients anémiques, sauf les plus légers, et donner une indication de la gravité.
Une première étude a démontré la capacité du test à identifier l’anémie (définie comme la ctHb
SUMMARY
La ctHb est l’un des deux paramètres couramment utilisés pour évaluer la capacité de transport d’oxygène du sang et ainsi établir un diagnostic d’anémie et de polyglobulie.
L’autre test, appelé hématocrite (Hct) ou volume cellulaire compact (VPC), a fait l’objet d’un précédent article complémentaire, où la relation entre la ctHb et l’Hct a été discutée . Le présent article s’est concentré sur la mesure de la ctHb.
De nombreuses méthodes ont été imaginées, la majorité étant basée sur la mesure de la couleur de l’hémoglobine ou d’un dérivé de l’hémoglobine. Pour cette courte revue, il a été inévitablement nécessaire d’être sélectif. Les méthodes choisies pour la discussion sont parmi les plus couramment utilisées aujourd’hui.
En faisant la sélection, une tentative a été faite pour transmettre la gamme de technologies qui sont actuellement employées et comment elles sont appliquées pour satisfaire la demande clinique de ctHb dans des contextes qui vont des zones appauvries du monde en développement, où les soins médicaux ont à peine un pied, au monde de haute technologie de l’unité de soins intensifs moderne.




