Polyester
La synthèse des polyesters est généralement réalisée par une réaction de polycondensation. Voir « réactions de condensation en chimie des polymères ».L’équation générale de la réaction d’un diol avec un diacide est :
(n+1) R(OH)2 + n R'(COOH)2 → HOnROH + 2n H2O.
Les polyesters peuvent être obtenus par une large gamme de réactions dont les plus importantes sont la réaction des acides et des alcools, l’alcoolyse et ou l’acidolyse des esters de faible poids moléculaire ou l’alcoolyse des chlorures d’acyle. La figure suivante donne un aperçu de ces réactions de polycondensation typiques pour la production de polyester. En outre, les polyesters sont accessibles par polymérisation par ouverture de cycle.

Estérification azéotropeEdit
Dans cette méthode classique, un alcool et un acide carboxylique réagissent pour former un ester carboxylique.Pour assembler un polymère, l’eau formée par la réaction doit être continuellement éliminée par distillation azéotrope.
Estérification par fusionEdit
Lorsque les points de fusion des monomères sont suffisamment bas, un polyester peut être formé par estérification directe tout en éliminant l’eau de réaction par le vide.
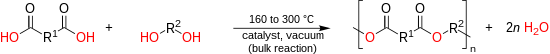
La polyesterification directe en masse à haute température (150 – 290 °C) est bien adaptée et utilisée à l’échelle industrielle pour la production de polyesters aliphatiques, de polyesters insaturés et de polyesters aromatiques-aliphatiques. Les monomères contenant des groupes phénoliques ou des groupes hydroxyle tertiaires présentent une faible réactivité avec les acides carboxyliques et ne peuvent pas être polymérisés par la polyestérification directe à base d’alcools acides. Dans le cas de la production de PET, le procédé direct présente toutefois plusieurs avantages, notamment une vitesse de réaction plus élevée, un poids moléculaire atteignable plus élevé, la libération d’eau au lieu de méthanol et des coûts de stockage plus faibles de l’acide par rapport à l’ester en raison du poids inférieur.
Transestérification alcooliqueEdit

Transestérification : Un oligomère terminé par un alcool et un oligomère terminé par un ester se condensent pour former une liaison ester, avec perte d’un alcool. R et R’ sont les deux chaînes oligomères, R » est une unité sacrificielle telle qu’un groupe méthyle (le méthanol est le sous-produit de la réaction d’estérification).
Le terme transestérification est généralement utilisé pour décrire les réactions d’échange hydroxy-ester, carboxy-ester et ester-ester. La réaction d’échange hydroxy-ester possède la plus grande vitesse de réaction et est utilisée pour la production de nombreux polyesters aromatiques-aliphatiques et entièrement aromatiques. La synthèse basée sur la transestérification est particulièrement utile lorsque des acides dicarboxyliques à haut point de fusion et peu solubles sont utilisés. En outre, les alcools en tant que produit de condensation sont plus volatils et donc plus faciles à éliminer que l’eau.
La synthèse par fusion à haute température entre les diacétates de bisphénol et les acides dicarboxyliques aromatiques ou à l’inverse entre les bisphénols et les diphénylesters d’acides dicarboxyliques aromatiques (réalisée entre 220 et 320 °C lors de la libération d’acide acétique) est, outre la synthèse à base de chlorure d’acyle, la voie préférée pour obtenir des polyesters entièrement aromatiques.
AcylationEdit
Dans l’acylation, l’acide commence sous forme de chlorure d’acide, et donc la polycondensation se déroule avec émission d’acide chlorhydrique (HCl) au lieu d’eau.
La réaction entre les chlorures de diacyle et les alcools ou les composés phénoliques a été largement appliquée à la synthèse du polyester et a fait l’objet de nombreuses revues et chapitres de livres. La réaction est réalisée à des températures plus basses que les méthodes d’équilibre ; les types possibles sont la condensation en solution à haute température, les réactions catalysées par les amines et les réactions interfaciales. En outre, l’utilisation d’agents activateurs est considérée comme une méthode hors équilibre. Les constantes d’équilibre pour la condensation à base de chlorure d’acyle donnant des arylates et des polyarylates sont en effet très élevées et seraient respectivement de 4,3 × 103 et 4,7 × 103. Cette réaction est donc souvent qualifiée de polyesterification « hors équilibre ». Même si la synthèse à base de chlorure d’acyle fait également l’objet de rapports dans la littérature des brevets, il est peu probable que la réaction soit utilisée à l’échelle de production. La méthode est limitée par le coût élevé des dichlorures d’acide, sa sensibilité à l’hydrolyse et l’apparition de réactions secondaires.
La réaction à haute température (100 à > 300 °C) d’un chlorure de diacyle avec un dialcool donne le polyester et le chlorure d’hydrogène. Sous ces températures relativement élevées, la réaction se déroule rapidement sans catalyseur :

La conversion de la réaction peut être suivie par titrage du chlorure d’hydrogène dégagé. Une grande variété de solvants a été décrite, notamment des benzènes chlorés (par exemple le dichlorobenzène), des naphtalènes ou des diphényles chlorés, ainsi que des aromatiques non chlorés comme les terphényles, les benzophénones ou les dibenzylbenzènes. La réaction a également été appliquée avec succès à la préparation de polymères hautement cristallins et peu solubles qui nécessitent des températures élevées pour être maintenus en solution (au moins jusqu’à l’obtention d’un poids moléculaire suffisamment élevé).
Dans une réaction interfaciale à base de chlorure d’acyle, l’alcool (généralement en fait un phénol) est dissous sous forme d’alcoolate dans une solution aqueuse d’hydroxyde de sodium, le chlorure d’acyle dans un solvant organique non miscible à l’eau tel que le dichlorométhane, le chlorobenzène ou l’hexane, la réaction se produit à l’interface sous agitation à grande vitesse au voisinage de la température ambiante.

Le procédé est utilisé pour la production de polyarylates (polyesters à base de bisphénols), de polyamides, de polycarbonates, de poly(thiocarbonate)s, et autres. Comme le poids moléculaire du produit obtenu par une synthèse à haute température peut être sérieusement limité par des réactions secondaires, ce problème est contourné par les températures douces de la polycondensation interfaciale. La procédure est appliquée à la production commerciale de polyarylates à base de bisphénol-A comme le U-Polymer d’Unitika. Dans certains cas, l’eau pourrait être remplacée par un solvant organique non miscible (par exemple, dans le système adiponitrile/tétrachlorure de carbone). Ce procédé est peu utile pour la production de polyesters à base de diols aliphatiques qui ont des valeurs de pKa plus élevées que les phénols et ne forment donc pas d’ions alcoolate en solution aqueuse. La réaction catalysée par une base d’un chlorure d’acyle avec un alcool peut également être réalisée en une phase en utilisant des amines tertiaires (par exemple la triéthylamine, Et3N) ou la pyridine comme accepteurs d’acide :
Alors que les polyestérifications à base de chlorure d’acyle ne se déroulent que très lentement à température ambiante sans catalyseur, l’amine accélère la réaction de plusieurs manières possibles, bien que le mécanisme ne soit pas entièrement compris. Cependant, il est connu que les amines tertiaires peuvent provoquer des réactions secondaires telles que la formation de cétènes et de dimères de cétènes.
Méthode silyle Dans cette variante de la méthode HCl, le chlorure d’acide carboxylique est converti avec l’éther triméthyl-silylique du composant alcool et on obtient la production de chlorure de triméthyl-silyle
Méthode de l’acétate (estérification)Edit

Méthode de l’acétate de silyle
Polymérisation par ouverture de cycleEdit

Des polyesters aliphatiques peuvent être assemblés à partir de lactones dans des conditions très douces, catalysés de manière anionique, cationique, métallorganique ou enzymatique. Un certain nombre de méthodes catalytiques pour la copolymérisation d’époxydes avec des anhydrides cycliques ont également été récemment montrées pour fournir un large éventail de polyesters fonctionnalisés, à la fois saturés et insaturés. La polymérisation par ouverture de cycle des lactones et des lactides est également appliquée à l’échelle industrielle.
Autres méthodesEdit
De nombreuses autres réactions ont été rapportées pour la synthèse de polyesters sélectionnés, mais sont limitées à des synthèses à l’échelle du laboratoire utilisant des conditions spécifiques, par exemple en utilisant des sels d’acides dicarboxyliques et des halogénures de dialkyle ou des réactions entre des biscétènes et des diols.
A la place des chlorures d’acyle, on peut utiliser des agents dits d’activation, tels que le 1,1′-carbonyldiimidazole, le dicyclohexylcarbodiimide ou l’anhydride trifluoroacétique. La polycondensation se déroule via la conversion in situ de l’acide carboxylique en un intermédiaire plus réactif tandis que les agents activateurs sont consommés. La réaction se déroule, par exemple, via un intermédiaire N-acylimidazole qui réagit avec l’alcoxyde de sodium à action catalytique :

L’utilisation d’agents d’activation pour la production de polyesters et de polyamides aromatiques à haut point de fusion dans des conditions douces a fait l’objet d’une recherche académique intensive depuis les années 1980, mais les réactions n’ont pas été acceptées commercialement car des résultats similaires peuvent être obtenus avec des réactifs moins chers.
Thermodynamique des réactions de polycondensationEdit
Les polyestérifications sont regroupées par certains auteurs en deux grandes catégories : a) les polyesterifications à l’équilibre (principalement les réactions d’échange alcool-acide, alcool-ester et acide-ester, réalisées en masse à haute température), et b) les polyesterifications hors équilibre, utilisant des monomères très réactifs (par exemple les chlorures d’acide ou les acides carboxyliques activés, réalisées le plus souvent à plus basse température en solution).
La polyesterification à base d’acide et d’alcool est un exemple de réaction d’équilibre. Le rapport entre le groupe ester formant le polymère (-C(O)O-) et le produit de condensation eau (H2O) contre les monomères à base d’acide (-C(O)OH) et à base d’alcool (-OH) est décrit par la constante d’équilibre KC.
K C = {\displaystyle K_{C}={\frac {}{}}}.

La constante d’équilibre de la polyestérification à base d’acide-alcool est typiquement KC ≤ 10, ce qui n’est pas assez élevé pour obtenir des polymères de poids moléculaire élevé (DPn ≥ 100), car le degré moyen en nombre de polymérisation (DPn) peut être calculé à partir de la constante d’équilibre KC.
D P n = K C 2 + 1 {\displaystyle DP_{n}~=~{\sqrt{K_{C}}}+1}

Dans les réactions à l’équilibre, il est donc nécessaire d’éliminer le produit de condensation de manière continue et efficace du milieu réactionnel afin de conduire l’équilibre vers le polymère. Le produit de condensation est donc éliminé à pression réduite et à haute température (150-320 °C, selon les monomères) pour éviter la réaction en retour. Avec la progression de la réaction, la concentration des extrémités de chaîne actives diminue et la viscosité de la masse fondue ou de la solution augmente. Pour une augmentation de la vitesse de réaction, la réaction est effectuée à une concentration élevée de groupes terminaux (de préférence dans la masse), favorisée par les températures élevées.
Des constantes d’équilibre de l’ordre de KC ≥ 104 sont atteintes lors de l’utilisation de réactifs (chlorures d’acide ou anhydrides d’acide) ou d’agents activateurs comme le 1,1′-carbonyldiimidazole. En utilisant ces réactifs, les poids moléculaires requis pour les applications techniques peuvent être atteints même sans élimination active du produit de condensation.




