Kémia
Az oldat képződése a spontán folyamat példája, olyan folyamat, amely meghatározott körülmények között, valamilyen külső forrásból származó energia igénybevétele nélkül megy végbe. Néha megkeverünk egy keveréket, hogy felgyorsítsuk az oldódási folyamatot, de ez nem szükséges; homogén oldat keletkezne, ha elég sokáig várnánk. A spontaneitás témája kritikusan fontos a kémiai termodinamika tanulmányozása szempontjából, és a szöveg egy későbbi fejezetében alaposabban tárgyaljuk. E fejezet tárgyalása céljából elegendő két olyan kritériumot megvizsgálni, amelyek kedveznek az oldat spontán képződésének, de nem garantálják azt:
- a rendszer belső energiájának csökkenése (exoterm változás, amint azt a termokémiáról szóló előző fejezetben tárgyaltuk)
- a rendszer rendezetlenségének növekedése (ami a rendszer entrópiájának növekedését jelzi, amint azt a termodinamikáról szóló későbbi fejezetben megismerhetjük)
Az oldódás folyamatában gyakran, de nem mindig belső energiaváltozás következik be hőfelvétel vagy hőfejlődés formájában. Az oldat kialakulásakor mindig a rendezetlenség növekedése következik be.
Ha az oldatban lévő oldott anyag és oldószer fajok közötti molekulák közötti vonzóerők erősségei nem különböznek az elválasztott komponensek erősségeitől, az oldat kísérő energiaváltozás nélkül alakul ki. Az ilyen oldatot ideális oldatnak nevezzük. Ideális gázok (vagy olyan gázok, mint a hélium és az argon, amelyek közelítenek az ideális viselkedéshez) keveréke az ideális oldat példája, mivel az ezeket a gázokat alkotó egységek nem tapasztalnak jelentős molekulák közötti vonzóerőt.
Héliumot és argont tartalmazó tartályok összekapcsolásakor a gázok spontán keverednek a diffúzió következtében, és oldatot képeznek (2. ábra). Ennek az oldatnak a kialakulása egyértelműen a rendezetlenség növekedésével jár, mivel a hélium és az argon atomok kétszer akkora térfogatot foglalnak el, mint amekkorát a keveredés előtt mindegyikük elfoglalt.
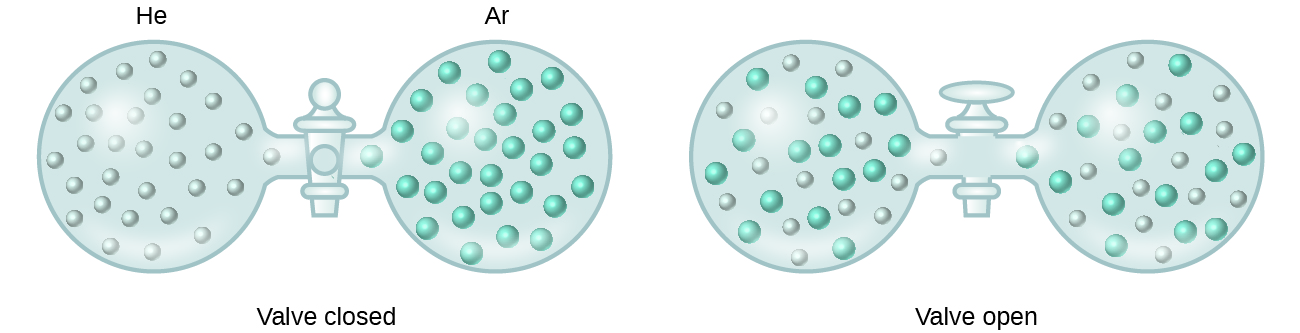
A szerkezetileg hasonló folyadékok keveredésekor is kialakulhatnak ideális oldatok. Például a metanol (CH3OH) és az etanol (C2H5OH) alkoholok keverékei ideális oldatokat alkotnak, akárcsak a pentán (C5H12) és a hexán (C6H14) szénhidrogének keverékei. A metanol és az etanol, illetve a pentán és a hexán elhelyezése a 2. ábrán látható égőkben ugyanolyan diffúziót és ezt követő keveredést eredményez ezeknek a folyadékoknak, mint amit a He és Ar gázok esetében megfigyelhetünk (bár sokkal lassabb sebességgel), és így olyan oldatokat kapunk, amelyek energiája nem változik jelentősen. A gázok keverékétől eltérően azonban ezeknek a folyadék-folyadék oldatoknak az összetevői között valóban intermolekuláris vonzóerők lépnek fel. Mivel azonban a két keveredő anyag molekulái szerkezetileg nagyon hasonlóak, a hasonló és nem hasonló molekulák közötti molekulák közötti vonzóerők lényegében azonosak, ezért az oldódási folyamat nem jár számottevő energia-növekedéssel vagy -csökkenéssel. Ezek a példák szemléltetik, hogy a diffúzió önmagában is képes biztosítani az oldat spontán kialakulásához szükséges hajtóerőt. Bizonyos esetekben azonban az oldott anyag és az oldószer fajok közötti intermolekuláris vonzóerők relatív nagysága megakadályozhatja az oldódást.
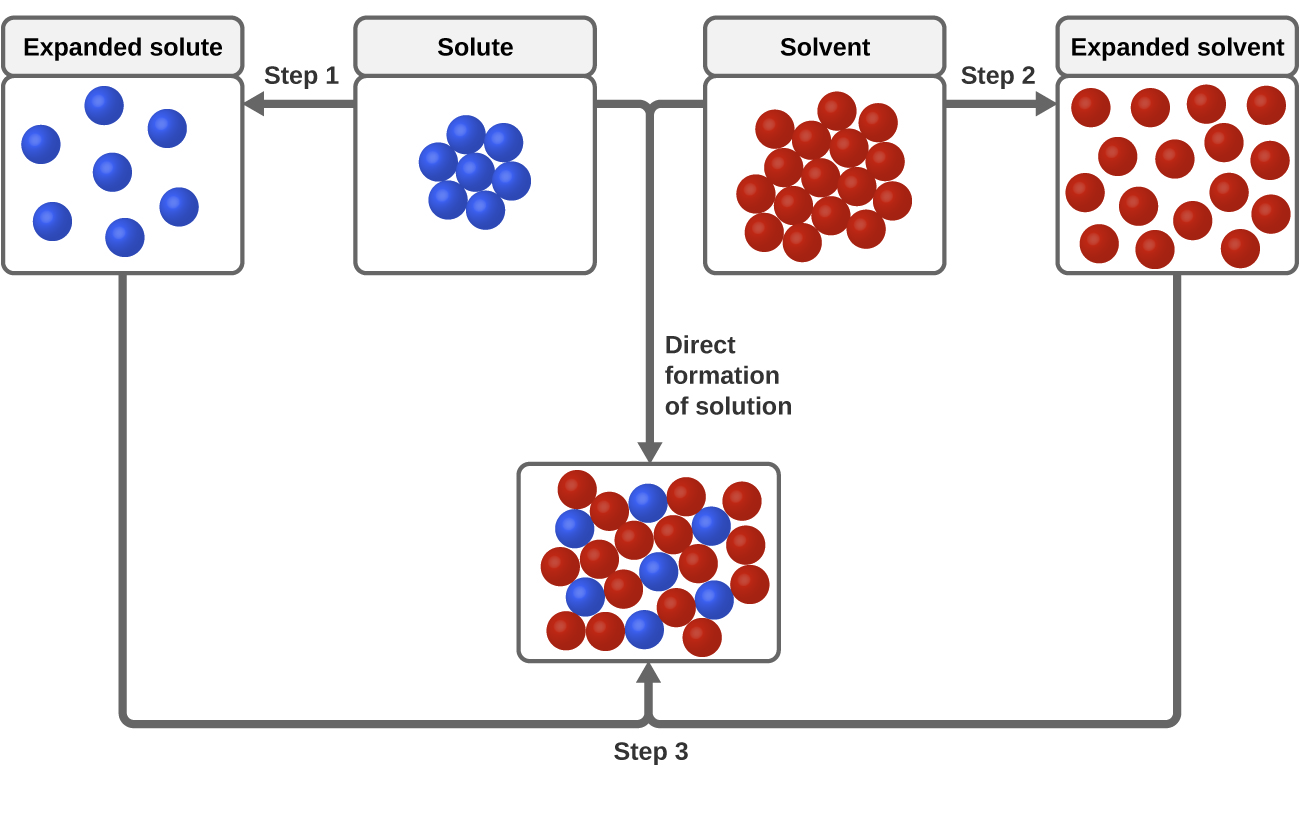
Az oldódási folyamat szempontjából háromféle intermolekuláris vonzóerő releváns: oldott anyag-oldott anyag, oldószer-oldószer és oldott anyag-oldószer. Amint azt a 3. ábra szemlélteti, az oldat képződését egy lépcsőzetes folyamatnak tekinthetjük, amelyben az oldott anyag-oldószer és oldószer-oldószer vonzások leküzdésére energia fogy (endoterm folyamatok), és energia szabadul fel, amikor az oldott anyag-oldószer vonzások létrejönnek (szolvatációnak nevezett exoterm folyamat). Az e lépcsőzetes folyamatokhoz kapcsolódó energiaváltozások relatív nagysága határozza meg, hogy az oldódási folyamat összességében energiát szabadít fel vagy vesz fel. Egyes esetekben azért nem alakulnak ki oldatok, mert az oldott és az oldószerfajok szétválasztásához szükséges energia sokkal nagyobb, mint az oldódás során felszabaduló energia.
Az étolajok és a víz például nem keverednek számottevő mértékben, hogy oldatot kapjanak (4. ábra). A hidrogénkötés a folyékony vízben jelenlévő domináns intermolekuláris vonzóerő; az étolajok nem poláros szénhidrogénmolekulái nem képesek hidrogénkötésre, ehelyett diszperziós erők tartják össze őket. Az olaj-víz oldat kialakításához le kellene küzdeni a vízben lévő nagyon erős hidrogénkötést, valamint a viszonylag nagy olajmolekulák közötti, jelentősen erős diszperziós erőket. És mivel a poláros vízmolekulák és a nem poláros olajmolekulák között nem lenne nagyon erős a molekulák közötti vonzás, az oldódás során nagyon kevés energia szabadulna fel.

Az etanol és a víz keveréke viszont bármilyen arányban keveredve oldatot ad. Ebben az esetben mindkét anyag képes hidrogénkötésre, így az oldódási folyamat kellően exoterm ahhoz, hogy kompenzálja az oldott anyag és az oldószer molekulák endoterm elválását.
Amint azt a modul elején megjegyeztük, a spontán oldatképződésnek kedveznek, de nem garantálják az exoterm oldódási folyamatok. Míg sok oldható vegyület valóban hőfelszabadulással oldódik, egyesek endoterm módon oldódnak. Ilyen például az ammónium-nitrát (NH4NO3), amelyet az 5. ábrán láthatóhoz hasonló, sérülések kezelésére szolgáló azonnali hűtőcsomagok készítésére használnak. Egy vékony falú, vizet tartalmazó műanyag zacskó egy nagyobb, szilárd NH4NO3-at tartalmazó zacskó belsejében van lezárva. Amikor a kisebb zacskót felbontják, NH4NO3 oldat képződik, amely elnyeli a hőt a környezetből (a sérült területből, amelyre a csomagot helyezik), és hideg borogatást biztosít, amely csökkenti a duzzanatot. Az ehhez hasonló endoterm oldódások nagyobb energiabefektetést igényelnek az oldott anyagfajok szétválasztásához, mint amennyit az oldott anyagok oldódásakor visszanyernek, de az oldat kialakulását kísérő rendezetlenség növekedése miatt ennek ellenére spontán lezajlanak.


Nézze meg ezt az endoterm és exoterm oldódási folyamatokat bemutató rövid videót.
Fő fogalmak és összefoglalás
Egy oldat akkor képződik, amikor két vagy több anyag fizikailag egyesül, hogy molekuláris szinten homogén keveréket kapjon. Az oldószer a legkoncentráltabb komponens, és meghatározza az oldat fizikai állapotát. Az oldott anyagok a többi komponens, amelyek jellemzően az oldószerénél kisebb koncentrációban vannak jelen. Az oldatok az oldott anyag és az oldószer molekulák közötti vonzóerők relatív nagyságától függően endoterm vagy exoterm módon alakulhatnak ki. Az ideális oldatok észrevehető energiaváltozás nélkül alakulnak ki.
Kémia fejezet végi gyakorlatok
- Miben különböznek az oldatok a vegyületektől? Más elegyektől?
- Az oldatok főbb jellemzői közül melyeket láthatunk az 1. ábrán látható K2Cr2O7 oldatokban?
- Amikor a KNO3 vízben oldódik, a keletkező oldat lényegesen hidegebb, mint a víz eredetileg volt.
(a) A KNO3 oldódása endoterm vagy exoterm folyamat?
(b) Milyen következtetéseket tudsz levonni a folyamatban résztvevő molekulák közötti vonzásokról?
(c) A keletkező oldat ideális oldat-e?
- Adjon egy-egy példát az alábbi oldattípusok mindegyikére:
(a) gáz folyadékban
(b) gáz gázban
(c) szilárd anyag szilárd anyagban
- Mutassa meg a molekulák közötti vonzások legfontosabb típusait az alábbi oldatok mindegyikében:
(a) Az 1. ábrán látható oldat.
(b) NO(l) CO(l)-ben
(c) Cl2(g) Br2(l)-ben
(d) HCl(aq) benzolban C6H6(l)
(e) metanol CH3OH(l) H2O(l)-ben
.
- Jósold meg, hogy az alábbi anyagok mindegyike jobban oldódik-e vízben (poláris oldószer) vagy szénhidrogénben, például heptánban (C7H16, nem poláris oldószer):
(a) növényi olaj (nem poláris)
(b) izopropil-alkohol (poláris)
(c) káliumbromid (ionos)
- Egyik oldat képződésekor hő szabadul fel; más oldatok képződésekor hő veszik fel. Adjon molekuláris magyarázatot e kétféle spontán folyamat közötti különbségre.
- Palládiumban hidrogénoldatok keletkezhetnek, ha a Pd fémet H2 gáznak tesszük ki. A palládiumban lévő hidrogén koncentrációja függ az alkalmazott H2 gáz nyomásától, de bonyolultabb módon, mint ahogy azt a Henry-törvény leírhatja. Bizonyos körülmények között 0,94 g hidrogéngáz oldódik 215 g palládiumfémben.
(a) Határozzuk meg ennek az oldatnak a molaritását (oldatsűrűség = 1,8 g/cm3).
(b) Határozza meg ennek az oldatnak a molalitását (oldatsűrűség = 1,8 g/cm3).
(c) Határozza meg a hidrogénatomok tömegszázalékát ebben az oldatban (oldatsűrűség = 1,8 g/cm3).




