Mechanizmus – Hogyan gátolja az ibuprofén (Advil; Motrin) az aszpirin antitrombotikus hatását
Aki egy egyszerű irodalmi keresést végez, cikkek sokaságával találkozik, amelyek ezt a témát tárgyalják, vitatják, sőt vitatkoznak is.Véleményünk szerint mindezen kérdések oka az, hogy a tanulmányok között számos ellentmondás van az alkalmazott ibuprofén dózisában és időtartamában, az ibuprofén adagolásának az aszpirin beadásához viszonyított időzítésében, az alkalmazott aszpirin dózisában és formulájában (bélsavval bevont vagy nem bevont), a vizsgált betegpopulációban (egészséges önkéntesek vs. egészségesek), az aszpirin adagolásában és formulájában (bélsavval bevont vagy nem bevont), a vizsgált betegpopulációban (egészséges önkéntesek vs. egészségesek). ismert szív- és érrendszeri betegségben (CVD) szenvedő betegek), azt, hogy helyettesítő laboratóriumi markereket használtak-e olyan vizsgálatokkal szemben, amelyek ténylegesen értékelik a vérlemezke-aggregációt, és végül a vizsgálati terv, amelyet a vizsgálatot végzők az eredményeik megállapításához alkalmaztak.1-6 Így nagyon nehéz, sőt, szinte lehetetlen extrapolálni az egyes vizsgálatokból származó jelenlegi adatokat, amelyek mindegyike korlátozott vagy ellentmondásos egymás között, és olyan végleges választ adni, amely valóban lefordítható az általános populációra alkalmazható, klinikailag értelmezhető végpontokra. A szakirodalomban található ellentmondások egy része annak tudható be, hogy a vérlemezkék képesek aggregálódni akkor, amikor a nem-szteroid gyulladáscsökkentők (NSAID-ok) koncentrációja alacsony, szemben a beadást követő korai időszakkal, amikor a koncentráció magasabb.7 Mire az ibuprofén felszabadul a COX-1 kötőhelyéről, az aszpirin egy része már kiürült a szervezetből.
AzFood & Drug Administration (FDA) egészségügyi szakembereknek szóló figyelmeztetése nemrégiben kimondta: “Azoknak a betegeknek, akik azonnali felszabadulású aszpirint használnak (nem bélbevonatú) és egyszeri 400 mg ibuprofent szednek, az ibuprofent legalább 30 perccel az aszpirin bevétele után, vagy több mint 8 órával az aszpirin bevétele előtt kell beadniuk, hogy elkerüljék az aszpirin hatásának gyengülését. Ezenfelül számos tanulmány ellentmondásos eredményekkel rendelkezik. “8 Ezen ajánlás alapján e szám célja nem az, hogy kritizáljon minden egyes, e témában közzétett tanulmányt, hanem inkább az, hogy elmagyarázza a gyógyszerkölcsönhatás javasolt mechanizmusát, majd rávilágítson néhány problémára annak értelmezésével kapcsolatban az orvosi szakirodalomban.
Mi történik a normális vérlemezkeaggregáció során?
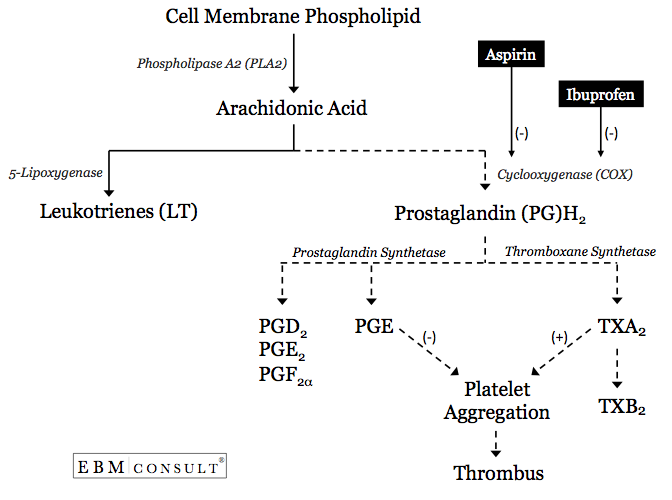
- A fokozott vérlemezkeaggregáció folyamata az arachidonsav (AA) felszabadulásával kezdődik a vérlemezke sejtmembránjából.6
- Az AA ezután két metabolikus útvonal egyikén haladhat végig, a delipoxigenáz útvonalon, amely leukotriéneket (LT) hoz létre, vagy a ciklooxigenáz (COX)-1 útvonalon, prosztaglandin (PG) H2-t képezve.9 A prosztaglandin H2-t ezután a prosztaglandinszintetáz metabolizálhatja más PG-ket képezve, vagy a tromboxán (TX)szintetáz metabolizálhatja TXA2-t képezve.
- Ha TXA2 képződik, akkor a vérlemezkék aggregációját megkönnyítik vagy elősegítik.10 Ez kifejezetten akkor következik be, ha az AA képes áthaladni egy hidrofób csatornán, ahol kapcsolatba léphet a COX-1 enzim katalitikus helyével. Ha ez a csatorna vagy a katalitikus helyet körülvevő területek blokkolva vannak, az AA nem tud PGH2-vé, majd TXA2-vé metabolizálódni, ezáltal csökkentve a trombocitaaggregáció valószínűségét.6,9,11.
Hogyan befolyásolja az aszpirin a trombocitaaggregációt?
- Aszpirin beadásakor irreverzibilisen acetilál egy szerinmaradékot az 529. pozícióban a hidrofób csatornán belül, amely a katalitikus hely közelében van, ahol az AA-t a COX-1 enzim a trombocita származék TXA2-re metabolizálja.6,9,11. Ennek a területnek az acetilálása olyan blokádot hoz létre, ahol az AA nem tud hozzáférni a COX-1-en belüli katalitikus helyhez.
- Mivel az aszpirin ezt irreverzibilisen teszi, a COX-1 enzimen belüli katalitikus helynek az AA metabolizálására való képessége blokkolva vagy gátolva van az adott vérlemezke élettartamára (általában körülbelül 7-12 napig). Ez az egyik fő oka annak, hogy az aszpirin kardioprotektív előnyt biztosít a szív- és érrendszeri eseményekkel szemben, amikor elsősorban másodlagos megelőzésre alkalmazzák.
- Ezért, ha bármi más versenyez vagy blokkolja az aszpirin hozzáférését a COX-1 enzimben lévő szerin-maradék acetilálásához, a kardioprotektív előnyök csökkenhetnek.
Hogyan befolyásolja az ibuprofén az aszpirin farmakológiai aktivitását?
- Az ibuprofén, mint az összes NSAID, reverzibilis, kompetitív gátlója az AA-metabolizmus katalitikus helyének a COX-1 enzim hidrofób csatornájában.7,12,12
- Az ibuprofén jelenléte ebben a hidrofób csatornában kompetitív módon gátolja az aszpirin hozzáférését az AA katalitikus helyéhez közeli szerin-maradék acetilálásához.7,12,13
- Az ibuprofén által az aszpirin farmakológiai hatásának kifejtéséhez való hozzáférés gátlásának mértékét számos tényező befolyásolja.
Az első és legnyilvánvalóbb tényező az aszpirin és azibuprofén egymáshoz viszonyított beadási sorrendjéhez kapcsolódik. Ha az aszpirint adják először, akkor hozzáfér a COX-1 enzimben lévő szerinmaradványok visszafordíthatatlan acetilálásához. Ne feledjük, hogy ha az aszpirin egyszer már irreverzibilisen gátolta a COX-1 enzimet, a trombocitaellenes hatás az adott vérlemezke élethosszig fennmarad. A következő tényező a jelen lévőibuprofén koncentrációja az aszpirin együttes alkalmazásának időpontjához viszonyítva. Mivel az ibuprofén gátlása kompetitív, a trombocitaaggregációt nem csak a jelen lévő ibuprofén koncentrációja befolyásolja, hanem természeténél fogva reverzibilis is. Ezért, ahogy a gyógyszer szintje csökken az eliminációs utakon keresztül, az ibuprofén azon mennyisége is csökken, amely képes blokkolni az aszpirin aktív helyhez való hozzáférését, különösen tekintettel az ibuprofén rövid, 2-4 órás felezési idejére.14 Az ibuprofénnek ez a farmakokinetikai jellemzője az oka annak, hogy a nap folyamán többször kell újra adagolni, míg az aszpirint csak naponta egyszer kell adagolni. Ezért érthető, hogy miért vannak eltérések az orvosi szakirodalomban közzétett több tanulmány eredményei között. Így e gyógyszerkölcsönhatás klinikai hatását befolyásolja a két gyógyszer beadásának sorrendje, az alkalmazott aszpirin adagja és formulája, az alkalmazottibuprofén adagja és beadásának gyakorisága, a vizsgált betegpopuláció és a vizsgálat végpontjának típusa.
Az igazi kérdés végül az, hogy ez a kölcsönhatás klinikailag releváns, előre meghatározott, betegorientált, kardiovaszkulárisan meghatározott kimenetelre vezethető-e vissza. Tudomásunk szerint ilyen prospektív, megfelelően tervezett klinikai vizsgálatot még nem végeztek, hogy meggyőző adatokkal válaszoljanak erre a kérdésre a szóban forgó betegpopulációban.
- GengoFM, Rubin L, Robson M et al. Effects of ibuprofen on the magnitudude andduration of aspirin’s inhibition of platelet aggregation: clinical consequences in stroke prophylaxis. J Clin Pharmacol 2008;48:117-22.
- GladdingPA, Webster MWI, Farrell HB et al. The antiplatelet effect of sixnon-steroidal anti-inflammatory drugs and their pharmacodynamic interactionswith aspirin in healthy volunteers. Am J Cardiol 2008;101:1060-1063.
- CryerB, Berlin RG, Copper SA et al. Double-blind, randomizált, párhuzamos, placebo-kontrollált vizsgálat az ibuprofen hatásáról a tromboxán B2 koncentrációra aszpirinnel kezelt egészséges felnőtt önkéntesekben. Clin Ther2005;27:185-191.
- MacDonaldTM, Wei L et al. Az ibuprofen hatása azaspirin kardioprotektív hatására. Lancet 2003;361:573-74.
- KurthT, Glynn RJ, Walker AM et al. Inhibition of clinical benefits of aspirinon first myocardial infarction by nonsteroidal antiinflammatory drugs. Circulation 2003;108:1191-1195.
- Catella-LawsonF, Reilly MP, Kapoor SC et al. Cyclooxygenase inhibitors and theantiplatelet effects of aspirin. N Engl J Med 2001;345:1809-17.
- EvansAM. A profének farmakodinamikája és farmakokinetikája:enantioszelektivitás, klinikai vonatkozások és különös tekintettel aS(+)-ibuprofénre. J Clin Pharmacol 1996;36:7S-15S.
- Food& Drug Administration. Tájékoztatás az egészségügyi szakemberek számára: Az ibuprofen és az aszpirin egyidejű alkalmazása. U.S. Department of Health &Human Services. Utolsó hozzáférés: 09-19-2011.
- FunkCD, Funk LB, Kennedy ME et al. Human platelet/erythroleukemia cellprostaglandin G/H synthase: cDNA cloning, expression, and gene chromosomalassignment. FASEB J 1991;5:2304-12.
- FitzgeraldGA. A vérlemezkeaktiváció mechanizmusai: a tromboxán A2 mint más agonisták amplifikáló jele. Am J Cardiol 1991;68:11B-15B.
- LollPJ, Picot D, Garavito RM. Az aszpirin aktivitásának szerkezeti alapjaiaz inaktivált prosztaglandin H2-szintáz kristályszerkezetéből következtetve. Nat Struct Biol 1995;2:637-43.
- LollPJ, Picot D, Ekabo O et al. Synthesis and use of iodinated nonsteroidalantiinflammatory drug analogs as crystallographic probes of the prostaglandinH2 synthase cyclooxygenase active site. Biokémia 1996;35:7330-40.
- RaoGH, Johnson GG, Reddy KR et al. Ibuprofen protects plateletcyclooxygenase from irreversible inhibition by aspirin. Arteriosclerosis 1983;3:383-8.




