Nátrium-klorid, NaCl
Az ionos kötés klasszikus esete, a nátrium-klorid molekula a nátrium- és klóratomok ionizációja és a keletkező ionok vonzása révén alakul ki.
Egy nátriumatomnak egy 3s elektronja van a zárt héjon kívül, és ennek az elektronnak az eltávolításához mindössze 5,14 elektronvolt energiára van szükség. A klórnak hiányzik egy elektronja a héj kitöltéséhez, és 3,62 eV-ot szabadít fel, amikor megszerzi ezt az elektront (elektronaffinitása 3,62 eV). ez azt jelenti, hogy csak 1,52 eV energiára van szükség ahhoz, hogy a nátrium egyik elektronját a klórnak adja, amikor távol vannak egymástól. Amikor a keletkező ionok közelebb kerülnek egymáshoz, az elektromos potenciális energiájuk egyre negatívabbá válik, és körülbelül 0,94 nm távolságnál eléri a -1,52 eV-ot. Ez azt jelenti, hogy ha a semleges nátrium- és klóratomok 0,94 nm-nél közelebb kerülnének egymáshoz, akkor energetikailag kedvező lenne egy elektront átadni a Na-ról a Cl-re, és ionos kötés jönne létre.
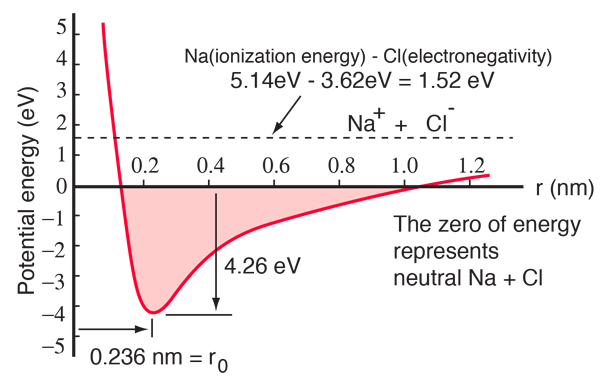
A potenciális energia görbe azt mutatja, hogy 0,236 nm távolságnál van egy minimum, majd a potenciál meredeken emelkedik, ami taszító erőt jelent. Ez a taszító erő több mint egyszerű elektrosztatikus taszítás a két atom elektronfelhője között. Kvantummechanikai jellege van, amely a Pauli-féle kizárási elvben gyökerezik, és gyakran csak “kizárási elven alapuló taszításnak” nevezik. Ha az ionok nagy távolságra vannak egymástól, a magelektronjaik hullámfüggvényei nem fedik egymást jelentősen, és azonos kvantumszámúak lehetnek. Ahogy közelednek egymáshoz, a hullámfüggvények növekvő átfedése miatt egyesek magasabb energiaállapotokba kényszerülnek. Két elektron nem foglalhatja el ugyanazt az állapotot, így ahogy az összetett, két magból álló rendszerben új energiaállapotok alakulnak ki, az alacsonyabb energiaállapotok kitöltődnek, és az elektronok egy része magasabb állapotokba kényszerül. Ez energiát igényel, és taszításként tapasztalható, ami megakadályozza, hogy az ionok közelebb kerüljenek egymáshoz.
A fenti potenciáldiagram a gáz halmazállapotú NaCl-re vonatkozik, a környezet más a normál szilárd állapotban, ahol a nátrium-klorid (konyhasó) kocka alakú kristályokat alkot. Az ionkülönbség 0,28 nm, ami valamivel nagyobb, mint a gáz halmazállapotban.
A molekulaszerkezet tanulmányozásának jelentős része az atomok között kialakuló kémiai kötések leírása. A klasszikus vizsgálatok a nátrium-kloridban az ionos kötés és a hidrogénmolekulában a kovalens kötés szélsőségei.
| Kémiai kötések | Pauli-taszítás az ionos kötésekben |
A kötési energia példája




