6.17: Ioni poliatomici
La nostra discussione sui composti ionici si è limitata agli ioni monoatomici. Tuttavia, ioni più complessi, contenenti diversi atomi legati covalentemente l’uno all’altro, ma con una carica positiva o negativa, si verificano abbastanza frequentemente in chimica. La carica nasce perché il numero totale di elettroni di valenza degli atomi non può produrre una struttura stabile. Con l’aggiunta o la rimozione di uno o più elettroni, si ottiene una struttura stabile. Esempi ben noti di tali ioni poliatomici sono lo ione solfato (SO42-),
lo ione idrossido (OH-),
lo ione idronio (H3O+),
e lo ione ammonio (NH4+).
Gli atomi di questi ioni sono uniti da legami covalenti di coppia di elettroni, e possiamo disegnare le strutture di Lewis per gli ioni come per le molecole. L’unica differenza è che il numero di elettroni nello ione non bilancia esattamente la somma delle cariche nucleari. O ci sono troppi elettroni, nel qual caso abbiamo un anione, o troppo pochi, nel qual caso abbiamo un catione.
Consideriamo, per esempio, lo ione idrossido (OH-) per il quale la struttura di Lewis è
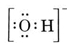
Una molecola neutra contenente un atomo di O e uno di H conterrebbe solo sette elettroni, sei da O e uno da H. Lo ione idrossido, però, contiene un ottetto di elettroni, uno in più della molecola neutra. Lo ione idrossido deve quindi portare una singola carica negativa. Per disegnare la struttura di Lewis per un dato ione, dobbiamo prima determinare quanti elettroni di valenza sono coinvolti. Supponiamo che sia richiesta la struttura di H3O+. Il numero totale di elettroni si ottiene sommando gli elettroni di valenza per ogni atomo, 6 + 1 + 1 + 1 = 9 elettroni. Ora dobbiamo sottrarre 1 elettrone perché la specie in esame non è H3O ma H3O+. Il numero totale di elettroni è quindi 9 – 1 = 8. Poiché si tratta di un ottetto di elettroni, possiamo disporli tutti intorno all’atomo di O. La struttura finale segue quindi molto facilmente:
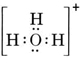
In casi più complicati è spesso utile calcolare il numero di coppie di elettroni condivisi prima di disegnare una struttura di Lewis. Questo è particolarmente vero quando lo ione in questione è un ossianione (cioè, un atomo centrale è circondato da diversi atomi O). Un ossianione ben noto è lo ione carbonato, che ha la formula CO32-. (Si noti che l’atomo centrale C è scritto per primo, come è stato fatto prima per le molecole). Il numero totale di elettroni di valenza disponibili in CO32- è
(4 \testo{(per C)} + 3 \tempo 6 \testo{(per O)} + 2 \testo{(per la carica -2)} = 24 \)
Dobbiamo distribuire questi elettroni su 4 atomi, dando a ciascuno un ottetto, un requisito di 4 × 8 = 32 elettroni. Ciò significa che 32 – 24 = 8 elettroni devono essere contati due volte ai fini dell’ottetto; cioè, 8 elettroni sono condivisi. Lo ione a contiene quindi quattro legami di coppia di elettroni. Presumibilmente l’atomo di C ha un doppio legame con uno degli O e un legame singolo con gli altri due:
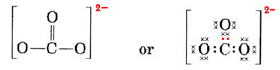
In questo diagramma i 4 elettroni di C sono stati rappresentati da punti, i 18 elettroni di O da ×, e i 2 elettroni extra da punti colorati, a scopo di facile riferimento. Gli elettroni reali non portano etichette come questa; sono tutti uguali.
C’è una seria obiezione alla struttura di Lewis appena disegnata. Come fanno gli elettroni a sapere quale atomo di ossigeno scegliere e formare un doppio legame, dato che altrimenti non c’è nulla che differenzi gli ossigeni? La risposta è che non lo fanno. Spiegare il legame nello ione CO32- e in alcune altre molecole richiede un’estensione della teoria di Lewis. Approfondiremo questo argomento quando parleremo della risonanza. Ora finiamo con un esempio.
Esempio (\PageIndex{1}}): Struttura di Lewis
Disegna una struttura di Lewis per lo ione solfito, SO32-.
Soluzione Il metodo più sicuro qui è contare gli elettroni. Il numero totale di elettroni di valenza disponibili è
6(per S) + 3 × 6(per O) + 2(per la carica) = 26Per fare quattro ottetti per i quattro atomi sarebbero necessari 32 elettroni, e così la differenza, 32 – 26 = 6, dà il numero di elettroni condivisi. Ci sono quindi solo tre legami di coppia di elettroni nello ione. L’atomo centrale S deve essere legato da un singolo legame ad ogni atomo O.
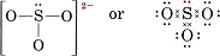
Nota che ognuno dei legami S-O è covalente coordinato.
Contribuenti
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.




