CHEM 101 – Elettroliti
ARGOMENTI DI CHIMICA GENERALE
Elettroliti
La dissociazione di composti ionici in acqua porta alla formazione di specie ioniche acquose mobili.Equazioni chimiche per dissoluzione e dissociazione in acqua. Elettroliti forti e deboli.
Gli elettroliti (accompagnamento musicale a questo argomento) sono sostanze che creano specie ioniche in soluzione acquosa. L’esistenza di portatori di carica in soluzione può essere dimostrata con un semplice esperimento. La conduttività dei mezzi acquosi può essere osservata usando una coppia di elettrodi, collegati a una fonte di tensione, che sono immersi nella soluzione. La corrente che la soluzione conduce può essere facilmente misurata, e una lampadina può essere usata come indicatore visivo della conducibilità di una soluzione.
Quando questo esperimento viene eseguito con acqua pura, la lampadina non si accende affatto. L’acqua stessa non conduce facilmente l’elettricità; è un esempio di una sostanza molecolare che è un non elettrolita. Questo è vero per molte altre sostanze molecolari. Per esempio, lo zucchero da tavola (saccarosio, C12H22O11) – è abbastanza solubile in acqua, ma una soluzione di zucchero apparentemente non conduce l’elettricità meglio della sola acqua. D’altra parte, quando eseguiamo l’esperimento con un composto ionico liberamente solubile come il cloruro di sodio, la lampadina brilla brillantemente.
Rappresentiamo ciò che pensiamo stia accadendo con questi casi contrastanti della dissoluzione di un composto molecolare e uno ionico scrivendo le seguenti equazioni chimiche:
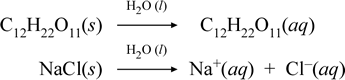
La prima equazione sopra rappresenta la dissoluzione di un non elettrolita, il composto molecolare saccarosio. La seconda equazione rappresenta la dissoluzione di un composto ionico, il cloruro di sodio. La distinzione chiave tra le due equazioni chimiche in questo caso è la formazione nel secondo di specie ioniche acquose come prodotti. Gli ioni sono liberi di diffondersi individualmente in una miscela omogenea, e quando viene applicata una tensione, gli ioni si muoveranno secondo la differenza di energia potenziale elettrica tra gli elettrodi, portando così corrente elettrica. Si noti che l’acqua non è mostrata sul lato reagente di queste equazioni, ma invece è mostrata sopra la freccia, indicando che l’acqua determina l’ambiente in cui avviene il processo di dissoluzione. Lo stato superstoichiometrico dell’acqua in questa simbologia può essere letto come un processo di dissoluzione che avviene con l’acqua come solvente. Non scriveremo l’acqua come reagente nella formazione di una soluzione acquosa per un semplice processo di dissoluzione. Ci sono molti casi in cui una sostanza reagisce con l’acqua mentre si mescola e si dissolve nell’acqua. Questa reazione di un soluto in soluzione acquosa dà origine a prodotti chimicamente distinti. In tali casi l’acqua può essere esplicitamente indicata nell’equazione chimica come specie reagente.
Elettroliti forti e deboli
Si scopre che quando un composto ionico solubile come il cloruro di sodio subisce la dissoluzione in acqua per formare una soluzione acquosa costituita da ioni solvatati, la freccia verso destra usata nell’equazione chimica è giustificata in quanto (finché il limite di solubilità non è stato raggiunto) il cloruro di sodio solido aggiunto all’acqua solvente si dissocia completamente. In altre parole, effettivamente c’è il 100% di conversione di NaCl(s) in Na+(aq) e Cl-(aq). Di conseguenza, nel nostro esperimento di conducibilità, una soluzione di cloruro di sodio è altamente conduttiva a causa dell’abbondanza di ioni, e la lampadina brilla intensamente. In tal caso, diciamo che il cloruro di sodio è un elettrolita forte.
Al contrario, consideriamo la sostanza molecolare acido acetico, HC2H3O2.Quando l’acido acetico è disciolto in acqua, forma una specie molecolare non associata, solvata, simboleggiata come HC2H3O2(aq), simile al caso del saccarosio sopra. Tuttavia, quando eseguiamo il nostro test di conducibilità con una soluzione di acido acetico, troviamo che la lampadina brilla, anche se piuttosto debolmente rispetto alla luminosità osservata per la soluzione di cloruro di sodio. In questo caso, ci deve essere almeno una parziale formazione di ioni dall’acido acetico in acqua. Un’equazione chimica che rappresenti questo processo deve mostrare la produzione di ioni. Una proposta ragionevole per tale equazione sarebbe:
![]()
Due cose sono importanti da notare qui. Primo, questo è un caso in cui includiamo l’acqua come reagente. Le due sostanze molecolari, acqua e acido acetico, reagiscono per formare gli ioni poliatomici idronio e acetato. L’equazione che rappresenta questo è un’equazione ionica. La seconda caratteristica che merita un’ulteriore discussione è la sostituzione della freccia verso destra con il simbolo delle doppie frecce a barra singola, che indica un equilibrio chimico e in questo caso la condizione di equilibrio per la reazione favorisce i reagenti, il che significa che in una soluzione acquosa di acido acetico, la maggior parte dell’acido acetico rimane come molecole di acido acetico, con solo una piccola parte in qualsiasi momento ha ceduto H+ all’acqua per formare gli ioni. Il piccolo numero di ioni prodotti spiega perché la soluzione di acido acetico non conduce l’elettricità così bene come la soluzione di cloruro di sodio, risultando solo in una debole illuminazione della lampadina del nostro rilevatore di conducibilità. Facciamo quindi una distinzione tra elettroliti forti, come il cloruro di sodio, e l’acido acetico, che è un esempio di elettrolita debole.
Come suggerisce il nome acido acetico, questa sostanza è anche un acido, oltre che un elettrolita debole. Di conseguenza, classifichiamo l’acido acetico come un acido debole. La nostra prima (e meno generale) definizione di un acido è una sostanza che crea ione idronio in acqua, che è proprio quello che la nostra equazione ionica sopra mostra, tenendo presente che un acido debole crea quantità relativamente piccole di ione idronio.
I chimici sono molto affezionati alle abbreviazioni, e un’abbreviazione importante per lo ione idronio è H+(aq), e questa è comunemente usata. Questo è mostrato nella versione abbreviata dell’equazione di cui sopra che è mostrata proprio qui sotto. Per essere chiari, H+ stesso sarebbe solo un protone isolato (per 1H); quindi è anche importante notare che nessuna specie del genere esiste in soluzione acquosa.
Inoltre, le frecce sono state fatte di lunghezza disuguale per indicare l’equilibrio favorito dal reagente, in cui ci sono molti meno ioni che molecole di acido acetico.
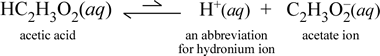
Rappresentando l’idronio come H+(aq), l’equazione ionica per l’acido acetico in acqua è formalmente bilanciata senza includere una molecola di acqua come reagente, che è implicita nell’equazione di sopra.
Ammonia: Un esempio di un elettrolita debole che è una base debole
L’acido acetico come abbiamo appena visto è un composto molecolare che è un acido debole e un elettrolita. Anche l’ammoniaca, NH3, un altro composto molecolare semplice, reagisce in piccola misura con l’acqua, formando ioni ammonio e idrossido. La nostra prima, meno generale definizione di una base è una sostanza che crea ioni idrossido in acqua. Così, l’ammoniaca è una base debole, e come l’acido acetico, non conduce l’elettricità quasi bene come il sale acquoso. Quindi anche l’ammoniaca è un elettrolita debole.
![]()
Il simbolismo della nostra equazione chimica indica di nuovo un equilibrio favorito dal reagente per l’elettrolita debole.
Estensioni e collegamenti
Un approccio più quantitativo agli equilibri usa acidi deboli e basi deboli come esempi importanti.




