CHEM 245 – Inibizione enzimatica
Temi di Biochimica
Inibizione enzimatica
Tipi di inibitori e inibizione. Modelli ed effetti cinetici dell’inibizione competitiva e non competitiva. Inibizione mista.Esempi di inibizione enzimatica.
La specificità degli enzimi non è strettamente limitata ai substrati. Spesso, l’attività di un enzima è ridotta da interazioni specifiche con molecole chiamate inibitori. L’inibizione degli enzimi è uno dei fenomeni più importanti in biochimica. Per esempio, molti farmaci, antibiotici e tossine esercitano i loro effetti grazie alla loro capacità di inibire un enzima. Gli inibitori che sono strutturalmente simili al substrato sono spesso inibitori competitivi, poiché competono per il legame al sito attivo. L’inibizione dell’enzima può essere reversibile (come avviene di solito quando un inibitore si lega all’enzima tramite interazioni non covalenti) o irreversibile (come avviene in numerosi casi in cui gli inibitori agiscono tramite modifiche covalenti dell’enzima, magari mirando a un residuo critico per la catalisi).
Possiamo immaginare diversi modelli semplici per l’inibizione reversibile. Il più semplice è l’occlusione diretta del sito attivo da parte dell’inibitore. Questo sarebbe visto nel caso di una molecola con una certa somiglianza strutturale con il substrato. Il legame del substrato e dell’inibitore si escludono a vicenda in questo modello di inibizione competitiva.
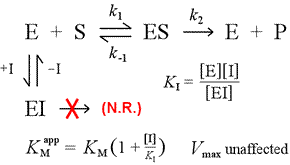
A destra è mostrato un semplice modello meccanicistico per l’inibizione competitiva. L’inibitore, I, si lega solo all’enzima libero E, con una costante di dissociazione KI , e blocca il legame del substrato (S). Legando parte dell’enzima nel complesso inattivo EI, meno di esso è disponibile ad una data concentrazione di substrato per combinarsi con il substrato e formare ES e quindi potenzialmente convertirsi in prodotti. Si osserverà un aumento del tempo necessario per raggiungere ½Vmax, quindi il valore apparente di KM aumenta.
aumentando a livelli sempre maggiori, il substrato può sopraffare l’inibitore, superando la concorrenza dell’enzima libero nella misura in cui la vera Vmax può ancora essere avvicinata.
Possiamo facilmente immaginare che una molecola che assomigli al substrato in alcune caratteristiche strutturali chiave possa competere con il substrato per il legame al sito attivo. Questo è chiamato un analogo del substrato, e fornisce esempi comuni di inibitori competitivi degli enzimi. Se il modo in cui gli enzimi aumentano i tassi di reazione è stabilizzando selettivamente lo stato di transizione della reazione, allora se possiamo trovare una molecola che assomiglia allo stato di transizione (in struttura e polarità o carica), tale analogo dello stato di transizione dovrebbe essere un ottimo inibitore competitivo.
Contrasteremo il modello di inibizione competitiva con l’inibizione non competitiva, in cui l’inibitore si lega solo al complesso enzima-substrato. Si può immaginare che ciò avvenga come risultato di un’interazione enzima-substrato di tipo indotto, in cui un sito di legame per un inibitore è disponibile esclusivamente nella conformazione indotta di ES.
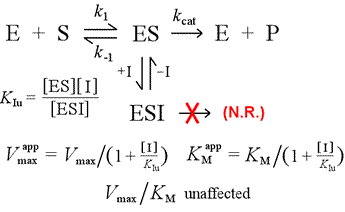
Sinistra: Un modello meccanicistico per l’inibizione non competitiva. In questo modello, l’inibitore lega solo il complesso ES e non l’enzima libero. Il complesso ternario, ESI, non procede verso i prodotti. Questo ha l’effetto di abbassare la Vmax apparente. La costante di dissociazione dell’inibitore per ESI è indicata come KIu. In un effetto spiegato dal principio di Le Châtelier, il KM apparente è più basso, poiché il legame dell’inibitore rimuove parte del prodotto (ES) dell'”equilibrio” di formazione dell’ES.
Un modello di inibizione in cui l’inibitore lega sia l’enzima libero che il complesso enzima-substrato è l’inibizione mista. La costante di dissociazione dell’inibitore può differire tra E e ES (cioè KI ≠ KIu). Il caso speciale in cui KI = KIu va sotto il nome di inibizione non competitiva. Si noti che in questo caso, KM non è influenzato, mentre Vmax è abbassato.
Tipi di inibizione enzimatica reversibile – un riassunto
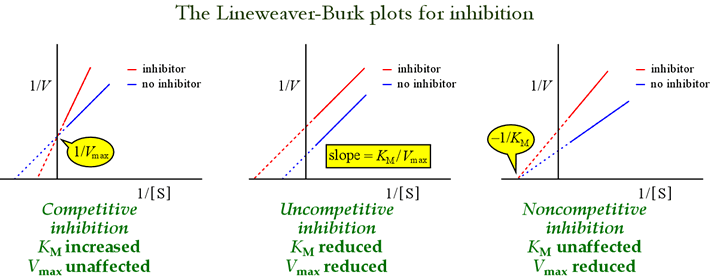
Abbiamo visto che i diversi modelli di inibizione reversibile possono essere distinti secondo gli effetti sui parametri cinetici. La tabella seguente riassume i tipi di inibizione e i loro effetti su questi parametri.

I grafici Lineweaver-Burk, o a doppia reciprocità, sono utili per identificare i modelli di inibizione. La figura qui sotto mostra come diversi tipi di inibizione influenzano il grafico.
Esempi di inibizione enzimatica
Il primo e più diffuso farmaco, l’acetilsalicilato (salicilato = ortoidrossibenzoato), comunemente noto come aspirina, è un efficace analgesico (antidolorifico), antipiretico (riduttore di febbre) e antinfiammatorio. Le proprietà medicinali della corteccia di salice erano note in alcune culture da secoli. Nel 19° secolo, l’ingrediente attivo è stato scoperto essere una combinazione di alcol e salicilico. Sulla base di queste e altre osservazioni, così come i progressi nella sintesi chimica, l’aspirina divenne disponibile a metà del secolo, essendo stata preparata da Hoffman, un chimico impiegato dalla Bayer. Indagini più moderne hanno stabilito che le proprietà medicinali dell’aspirina derivano in gran parte dalla sua capacità di inibire irreversibilmente un enzima noto come cicloossigenasi, che è necessario per la sintesi di prostaglandine e trombossani.
Le cicloossigenasi catalizzano il primo passo nella conversione dell’arachidonato in un precursore delle prostaglandine e dei trombossani, la prostaglandina G2 (PGG2, strutture e reazione). La reazione utilizza due molecole di O2 e converte l’acido grasso C20:4 in una molecola perossidata contenente un anello ciclopentano (PGG2 – PG sta per “prostaglandina”). L’enzima cicloossigenasi possiede anche un’attività idroperossidasi che converte il PGG2 in PGH2. Così, la “cicloossigenasi” (COX) sarebbe più precisamente designata come prostaglandina endoperossidasi H sintasi (PGHS). L’inibizione dell’attività della cicloossigenasi da parte dell’aspirina è dovuta alla sua capacità di modificare chimicamente un residuo di serina (Ser530) dell’enzima. Il residuo di serina acquisisce un gruppo acetile dall’aspirina, una modifica irreversibile. Così, l’aspirina è un esempio di inibitore irreversibile. Ci sono in realtà due isozimi COX: una forma costitutiva, COX-1 (PGHS-1), e una forma indotta (in condizioni di infiammazione), COX-2 (PGHS-2). I farmaci antinfiammatori non steroidei (FANS) come l’aspirina, l’ibuprofene e il naprossene generalmente inibiscono entrambe le isoforme. Di conseguenza, questi farmaci producono effetti collaterali indesiderati, ad esempio irritazione gastrointestinale. Quindi un obiettivo attuale della ricerca farmacologica è quello di sviluppare inibitori specifici per la COX-2, un effetto che si pensa medi la maggior parte degli effetti analgesici e antinfiammatori dei FANS.
Pagine di argomenti correlati:
- introduzione alla cinetica chimica
- introduzione all’enzimologia
- cinetica enzimatica
- equazione di Michaelis-Menten




