Fatti sul bario
Dal nome della parola greca barys per “pesante”, il bario è un metallo alcalino terroso relativamente denso e reattivo. Si trova in natura solo se combinato con altri elementi, e i composti che contengono bario hanno una vasta gamma di usi; si trovano nel veleno per topi, negli agenti ponderanti nei fluidi di perforazione del petrolio, e nel fluido bianco usato per visualizzare l’intestino in un test diagnostico a raggi X chiamato clistere di bario.
Solo i fatti
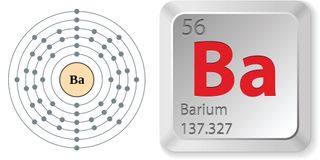
- Numero atomico (numero di protoni nel nucleo): 56
- Simbolo atomico (sulla tavola periodica degli elementi): Ba
- Peso atomico (massa media dell’atomo): 137,327
- Densità: 2,09 once per pollice cubo (3.62 grammi per cm cubo)
- Fase a temperatura ambiente: solido
- Punto di fusione: 1.341 gradi Fahrenheit (727 gradi Celsius)
- Punto di ebollizione: 3.447 F (1.897 C)
- Numero di isotopi naturali (atomi dello stesso elemento con un diverso numero di neutroni): 7
- Isotopo più comune: Ba-138
Scoperta del bario
Vincenzo Casciarolo, un alchimista italiano del XVII secolo, notò per la prima volta il bario sotto forma di sassi insoliti che brillavano per anni dopo l’esposizione al calore, secondo la Royal Society of Chemistry. Chiamò questi ciottoli “pietre di Bologna”, come la sua città natale, ma in seguito fu stabilito che si trattava di solfato di bario (BaSO4). Alla fine del XVIII secolo, l’ossido di bario (BaO) e il carbonato di bario (BaCO3) furono scoperti rispettivamente dal chimico tedesco Carl Scheele e dal chimico inglese William Withering.
Il bario metallico puro non fu isolato e identificato fino al 1808 alla Royal Institution di Londra. L’eminente chimico e inventore Sir Humphry Davy usò l’elettrolisi per separare il bario dai sali di bario fusi come l’idrossido di bario (Ba(OH)2). Durante l’elettrolisi, una corrente elettrica viene fatta scorrere attraverso la sostanza ionica per separare gli ioni gli uni dagli altri. Poiché i sali di bario erano fusi, gli ioni di bario si sono spostati facilmente verso il contenitore con l’elettrodo negativo, e gli altri ioni negativi si sono spostati facilmente nella direzione opposta al contenitore con l’elettrodo positivo.
Fonti di bario
Il bario si trova naturalmente solo in combinazione con altri elementi a causa del suo alto livello di reattività. Il bario si trova più comunemente combinato con solfato e carbonato, ma può anche formare composti con idrossido, cloruro, nitrato, clorato e altri ioni negativi. Circa lo 0,05% della crosta terrestre è bario, il che lo rende il 17° elemento più abbondante nella crosta, secondo Robert E. Krebs nel suo libro, “The History and Use of Our Earth’s Chemical Elements: A Reference Guide” (Greenwood Publishing Group, 2006). Le riserve minerarie nel Regno Unito, Italia, Repubblica Ceca, Stati Uniti e Germania contengono oltre 400 milioni di tonnellate di bario, secondo John Emsley nel suo libro “Nature’s Building Blocks: An A-Z Guide to the Elements” (Oxford University Press, 1999).
Per ottenere bario elementare puro, deve essere separato da altri elementi presenti nei composti di bario presenti in natura. Il bario può essere estratto dal cloruro di bario attraverso l’elettrolisi. Il bario può anche essere ottenuto riducendo l’ossido di bario usando alluminio o silicio in un vuoto ad alta temperatura e bassa pressione.
Proprietà del bario
Il bario puro è un metallo morbido, bianco argenteo. Classificato come un metallo alcalino-terroso, si trova nel gruppo, o colonna, 2 della tavola periodica, insieme a berillio, magnesio, calcio, stronzio e radio. Ognuno dei loro atomi contiene due elettroni di valenza (più esterni). Il bario è nel periodo, o fila, 5, quindi tiene i suoi elettroni di valenza nel suo quinto guscio e può perdere gli elettroni, o diventare ossidato, molto facilmente. Questo spiega l’alto livello di reattività del bario, specialmente con elementi elettronegativi come l’ossigeno.
Usi commerciali del bario
Il bario elementare non ha molti usi pratici, di nuovo a causa del suo alto livello di reattività. Tuttavia, la sua forte attrazione per l’ossigeno lo rende utile come “getter” per rimuovere le ultime tracce di aria nei tubi a vuoto. Il bario puro può anche essere combinato con altri metalli per formare leghe che sono usate per fare elementi di macchine come cuscinetti o candele nei motori a combustione interna. Poiché il bario ha una presa debole sui suoi elettroni, le sue leghe emettono elettroni facilmente quando vengono riscaldate e migliorano l’efficienza delle candele, secondo Krebs.
I composti contenenti bario hanno una varietà di usi commerciali. Il solfato di bario, o barite, è usato nel litopone (un pigmento che illumina la carta per stampanti e le vernici), nei fluidi di perforazione dei pozzi petroliferi, nella fabbricazione del vetro e nella creazione della gomma. Il carbonato di bario è usato come veleno per topi, e il nitrato di bario e il clorato di bario producono colori verdi nei fuochi d’artificio.
Il bario nel tuo corpo
L’adulto medio contiene circa 22 mg di bario perché è presente in cibi come carote, cipolle, lattuga, fagioli e cereali. I livelli di bario nei denti possono effettivamente aiutare gli scienziati a determinare quando i bambini passano dall’allattamento al seno al consumo di cibi solidi. Questi bassi livelli di bario non hanno alcun ruolo biologico e non sono dannosi.
Tuttavia, grandi quantità di sali di bario solubili possono essere tossiche e persino mortali, secondo John Emsley nel suo libro “The Elements of Murder: A History of Poison” (Oxford University Press, 2005). Il bario può causare vomito, coliche, diarrea, tremori e paralisi. Ci sono stati una manciata di omicidi con composti di bario, tra cui un omicidio del 1994 di un uomo a Mansfield, Texas, da sua figlia sedicenne, Marie Robards, che ha rubato acetato di bario dal suo laboratorio di chimica del liceo. Diversi pazienti sono stati anche accidentalmente uccisi dal bario quando il carbonato di bario solubile piuttosto che il solfato di bario insolubile è stato erroneamente utilizzato durante un test diagnostico gastroenterologico (GI) chiamato clistere di bario.
I medici eseguono clisteri di bario per visualizzare e diagnosticare anomalie dell’intestino crasso e del retto, secondo la Johns Hopkins Medicine. Durante la procedura, il solfato di bario viene instillato attraverso il retto per rivestire le pareti interne dell’intestino crasso. L’aria viene tipicamente somministrata dopo per assicurarsi che il rivestimento di bario riempia tutte le anomalie di superficie. Poi, i raggi X vengono utilizzati per produrre un’immagine del tratto gastrointestinale inferiore. Il solfato di bario assorbe i raggi X e appare bianco sulla pellicola a raggi X, in contrasto con l’aria e il tessuto circostante che appaiono neri. L’analisi dell’immagine a raggi X del clistere di bario permette ai medici di diagnosticare disturbi come la colite ulcerosa, il morbo di Crohn, i polipi, il cancro e la sindrome dell’intestino irritabile.




