Frontiers in Neuroscience
Introduzione
La generazione di nuovi neuroni nell’ippocampo adulto, una regione del cervello coinvolta nella navigazione spaziale e nella formazione della memoria (Buzsaki e Moser, 2013), è una forma sorprendente di plasticità che persiste per tutta la vita in diverse specie, compresi gli umani (Altman e Das, 1965; Eriksson et al, 1998; Moreno-Jiménez et al., 2019). Tra le molte condizioni che regolano la neurogenesi ippocampale adulta, uno dei processi più affidabili che è stato ampiamente descritto è il declino mediato dall’età della produzione neuronale, mentre le popolazioni neuronali preesistenti rimangono costanti con il normale invecchiamento (Kuhn et al., 1996; Kempermann et al., 1998; Burke e Barnes, 2010). L’invecchiamento influisce su molte funzioni del cervello, tra cui la trasmissione sinaptica e la plasticità, che si pensa possano contribuire alla perdita di memoria (Burke e Barnes, 2006; Fan et al., 2017). Dato che l’ippocampo è particolarmente vulnerabile alle alterazioni legate all’età e alla neurodegenerazione, trovare strategie per migliorare la plasticità in questa struttura diventa rilevante per prevenire o alleviare gli effetti della senescenza (Bartsch e Wulff, 2015). L’esercizio fisico e gli stimoli cognitivi migliorano la salute del cervello e tendono a migliorare gli effetti dell’invecchiamento. Uno dei benefici diretti può derivare dall’aumento dipendente dall’attività dei livelli di fattore neurotrofico derivato dal cervello (BDNF), che ha dimostrato di ripristinare la plasticità sinaptica, aumentare la neurogenesi e migliorare l’apprendimento nei topi di mezza età (Marlatt et al., 2012; Trinchero et al., 2017). L’esercizio fisico riduce anche l’attivazione della microglia, aumenta la plasticità sinaptica dipendente dall’attività, la proliferazione delle cellule progenitrici neurali e accelera lo sviluppo e l’integrazione delle cellule di granulo nate adulte (GC) nell’ippocampo che invecchia (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Questi effetti contribuiscono a ripristinare la plasticità ippocampale-dipendente e correlare con il comportamento adattivo. Così, gli animali invecchiati che eseguono male nell’apprendimento spaziale e nei compiti di separazione dei modelli, migliorano le loro prestazioni dopo l’esercizio (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
La misura in cui la neurogenesi contribuisce agli effetti comportamentali positivi dell’esercizio negli animali anziani è ancora sotto esame. È possibile che l’aumento del tasso di neurogenesi esercitato dall’esercizio fisico contribuisca al miglioramento comportamentale. Ma anche altri meccanismi possono essere implicati (Meshi et al., 2006). L’integrazione accelerata di nuovi neuroni nel giro dentato che invecchia dopo l’esercizio, che modifica la qualità dei nuovi GC, può anche contribuire al miglioramento comportamentale. Mentre i neuroni nati nei topi di mezza età si sviluppano lentamente, l’esercizio volontario sostenuto promuove la crescita dendritica, la formazione di spine e l’integrazione neuronale (Trinchero et al., 2017). Effetti simili sono stati osservati da brevi esposizioni all’arricchimento ambientale (EE) (Trinchero et al., 2019). Se accumulata su più coorti neuronali, l’integrazione neuronale accelerata innescata dall’esercizio potrebbe esercitare un’influenza significativa sull’apprendimento e sul comportamento dipendenti dall’ippocampo. In questo lavoro dimostriamo che diverse coorti di nuove CG possono essere rapidamente integrate nei circuiti preesistenti dei topi che continuano a impegnarsi nella corsa volontaria, e che questi effetti persistono una volta che i topi hanno smesso di correre.
Materiali e metodi
Topi e chirurgia
I topi maschi C57BL/6J sono stati alloggiati a 4-5 animali per gabbia in condizioni standard. Topi di otto mesi (8M) sono stati selezionati perché, oltre questa età, vi è un forte declino della neurogenesi ippocampale che preclude lo studio dei neuroni etichettati (Morgenstern et al., 2008; Trinchero et al., 2017). I topi sono stati anestetizzati (150 μg ketamina/15 μg xilazina in 10 μl di soluzione salina / g), e retrovirus è stato infuso nella regione settale del giro dentato destro (1.5 μl a 0.15 μl/min) utilizzando sterili pipette calibrate microcapillari attraverso la chirurgia stereotassica; coordinate dal bregma (in mm): -2 anteroposteriore, -1.5 laterale, e -1.9 ventrale. Ai tempi indicati, i cervelli sono stati fissati e sezioni sono stati preparati per l’imaging confocale (Trinchero et al., 2017). Solo GCs dal giro dentato settale sono stati inclusi nell’analisi, corrispondente alle sezioni localizzate da -0,96 a -2,30 mm dal bregma, secondo l’atlante del cervello del mouse (Paxinos e Franklin, 2001). Protocolli sperimentali sono stati approvati dal Comitato Istituzionale per la cura e l’uso degli animali della Fundación Instituto Leloir, secondo i principi per la ricerca biomedica che coinvolgono gli animali del Consiglio per le Organizzazioni Internazionali per le Scienze Mediche e le disposizioni indicate nella Guida per la cura e l’uso degli animali da laboratorio.
Running
Le distanze di corsa sono stati registrati per ogni esperimento utilizzando ruote da corsa wireless. Negli esperimenti della figura 1 gli animali sono stati alloggiati con una ruota da corsa per 7 o 21 giorni, come indicato. In questa condizione i topi hanno corso ∼2 km/giorno. Nelle figure 2, 3 in cui i topi hanno corso per 1, 2, o 3 mesi, la distanza monitorata era ∼10 km/giorno.
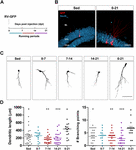
Figura 1. Lunghi ma non brevi periodi di corsa accelerano la maturazione morfologica dei nuovi GC. (A) Disegno sperimentale. RV-GFP iniezione è stata seguita da esposizione a 1 settimana di corsa volontaria alle finestre indicate o per l’intero esperimento (0-21 dpi). (B) Immagini rappresentative di 21-dpi GCs esprimendo GFP (rosso) preso da sedentari e 0-21 gruppi in esecuzione. NeuN (blu) etichetta lo strato di cellule di granulo (GCL) (ML, strato molecolare). Barra della scala, 50 μm. (C) Immagini rappresentative confocale di 21-dpi GFP-GCs per i diversi gruppi. Barra della scala, 50 μm. (D) complessità dendritica (lunghezza e punti di ramificazione) per le diverse finestre di esecuzione. ∗, ∗∗, e ∗∗∗ denotano p < 0,05, p < 0,01, e p < 0,001 rispetto al gruppo 0-21 corsa dopo Kruskal-Wallis test seguito dal test post hoc di Dunn. Nessuna differenza è stata trovata tra uno qualsiasi dei gruppi in esecuzione per 7 giorni. Dimensioni del campione (neuroni / topi): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21), e 15/3 (0-21). Le barre orizzontali indicano la media ± SEM. I cerchi aperti corrispondono a neuroni esempio.
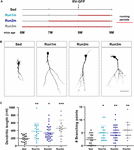
Figura 2. Effetti della corsa su diverse coorti neuronali. (A) Disegno sperimentale. RV-GFP iniezione è stata seguita da 3 settimane di corsa e preceduto da condizioni sedentarie (Run1m), 1 (Run2m), o 2 mesi di corsa (Run3m). Tutti i gruppi sono stati confrontati con topi sedentari (Sed). Lunghezza dendritica totale è stato analizzato a 21 dpi. (B) Rappresentante confocale immagini GFP-GCs. Barra della scala, 50 μm. (C) complessità dendritica (lunghezza e punti di ramificazione) per le diverse finestre di corsa. ∗, ∗∗, e ∗∗∗ denotano p < 0,05, p < 0,01, e p < 0,001 rispetto a Sed dopo Kruskal-Wallis test seguito dal test post hoc di Dunn. Dimensioni del campione (neuroni / topi): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m), e 15/3 (Run3m). Le barre orizzontali indicano la media ± SEM. Cerchi aperti corrispondono a neuroni esempio.

Figura 3. Effetti persistenti di esercizio cronico. (A) Disegno sperimentale. RV-GFP iniezione è stata seguita da 3 settimane di corsa (Run1m) o preceduto da 1 mese di esercizio (Run-1m) o 1 mese di esercizio e 1 mese senza la ruota in esecuzione (Run-2m). Tutti i gruppi sono stati confrontati con topi sedentari (Sed). Lunghezza dendritica totale è stato analizzato a 21 dpi. (B) Immagini rappresentative confocale di GCs etichettati. Barra della scala, 50 μm. (C) Complessità dendritica (lunghezza e punti di ramificazione) per le diverse finestre di esecuzione. ∗∗∗ denota p < 0.001 rispetto a Sed dopo il test Kruskal-Wallis seguito dal test post hoc di Dunn. Dimensioni del campione (neuroni / topi): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m), e 18/3 (Run-2m). (D) MFB morfologia in CA3 è stato analizzato per Run1m e Run-1m gruppi e rispetto a Sed. Immagini confocali rappresentative. Barra della scala, 5 μm. (E) ∗ e ∗∗ denotano p < 0.05 e p < 0.01 dopo Kruskal-Wallis test seguito dal test post hoc di Dunn. Dimensioni del campione: 27/4 (Sed), 32/4 (Run1m) e 18/4 (Run-1m). Le barre orizzontali indicano la media ± SEM. I cerchi aperti corrispondono a esempi di bouton.
Immunofluorescenza
L’immunocolorazione è stata effettuata su sezioni coronali di 60-μm. Gli anticorpi sono stati applicati in soluzione salina tamponata con tris (TBS) con 3% di siero d’asino e 0,25% di Triton X-100. L’immunofluorescenza è stata eseguita utilizzando anti GFP (coniglio policlonale; 1:500; Invitrogen), anti NeuN (mouse monoclonale; 1:50; un dono di F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Stati Uniti), asino anti-coniglio Cy3 e asino anti-mouse Cy5 anticorpi (1:250; Jackson Immuno Research Laboratories).
Microscopia confocale
Per le misure di lunghezza dendritica, le immagini sono state acquisite (40×; NA 1.3; immersione in olio) da sezioni di 60-μm di spessore prendendo stack Z tra cui 35-50 fette ottiche, unità ariosa = 1 a intervalli di 0,8-μm (Trinchero et al, 2017). Lunghezza dendritica è stato poi misurato utilizzando il software LSM Image Browser da proiezioni di ricostruzioni tridimensionali su un unico piano in GCs esprimendo GFP. Immagini di GFP-etichettato MFBs nella regione CA3 sono stati acquisiti a 0.4-μm intervalli (63 ×; NA 1.4; olio-immersione) e uno zoom digitale di 6. Area e numero di filopodia è stato analizzato da proiezioni di ricostruzioni tridimensionali su un singolo piano. Mossy boutons fibra (MFB) che soddisfano i seguenti criteri sono stati selezionati per la quantificazione: (i) il diametro del bouton era >tre volte più grande del diametro della fibra, (ii) il bouton era collegato alla fibra muscosa su almeno una estremità (Toni et al., 2008). Filopodia sono stati identificati come sporgenze derivanti da grandi terminali muscosi (1 μm < lunghezza < 20 μm) (Acsady et al., 1998). Le estensioni filopodiali sono state misurate contando il numero di protrusioni per terminale. Per l’acquisizione delle immagini e l’analisi delle proprietà morfologiche, tutti i gruppi sperimentali in studio erano ciechi all’operatore.
Analisi statistica
Se non diversamente specificato, i dati sono presentati come media ± SEM. La normalità è stata valutata utilizzando il test di Shapiro-Wilks, il test omnibus D’Agostino-Pearson e il test Kolmogorov-Smirnov, con un valore di p pari a 0,05. Quando i dati hanno soddisfatto i test di normalità (distribuzione gaussiana e varianza uguale), sono stati utilizzati, come indicato, il t-test non accoppiato con la correzione di Welch o l’ANOVA con il test post hoc di Bonferroni. Nei casi che non hanno soddisfatto la normalità, sono stati utilizzati test non parametrici come segue: Mann-Whitney’s test per i confronti indipendenti, e Kruskal-Wallis test per i confronti multipli.
Risultati
Abbiamo precedentemente dimostrato che la corsa accelera lo sviluppo e l’integrazione funzionale di nuovi GC nell’ippocampo di invecchiamento (Trinchero et al., 2017). Abbiamo ora indagato se questo tipo di plasticità richiede un livello persistente di attività che si accumula nel tempo, o se periodi più brevi di corsa possono anche innescare un’integrazione più rapida, come precedentemente osservato per l’esposizione a EE (Trinchero et al., 2019). Per affrontare questa domanda, nuove coorti neuronali sono state etichettate in topi di mezza età (8 mesi di età; 8M) utilizzando un retrovirus che esprime GFP (RV-GFP). I topi sono stati autorizzati a utilizzare una ruota in esecuzione per 1 settimana all’interno di diverse finestre di sviluppo neuronale, o di correre per l’intero intervallo di crescita neuronale (3 settimane; Figure 1A,B). Come descritto in precedenza, i nuovi GC hanno mostrato uno sviluppo lento nei topi sedentari, che ha portato a brevi dendriti con poche ramificazioni a 3 settimane. Una settimana in esecuzione non ha cambiato l’aspetto generale di nuovi GCs in nessuno degli intervalli testati (Figure 1C,D). Al contrario, la corsa per l’intero intervallo di 3 settimane ha portato ad un aumento della lunghezza dendritica e ramificazione, coerente con un’integrazione neuronale accelerata.
Gli effetti osservati di esercizio sono stati testati su una singola coorte neuronale, quella che è stata etichettata retroviralmente. Tuttavia, poiché nuovi GC vengono generati continuamente, è concepibile che i GC nati in momenti diversi all’interno del periodo di esercizio potrebbero anche essere influenzati dall’attività. Per testare questa ipotesi, abbiamo usato una semplice strategia per etichettare coorti neuronali nati in momenti diversi per quanto riguarda l’inizio dell’esercizio esponendo i topi alle ruote in esecuzione per diversi intervalli, ma sempre analizzando la struttura neuronale 3 settimane dopo l’iniezione retrovirale (denominata 1m per semplicità). Tre coorti sono stati così confrontati; uno in esecuzione per 3 settimane, etichettato proprio all’inizio dell’esercizio (Run1m), uno in esecuzione per 2 mesi, etichettato 1 mese dopo l’inizio dell’esercizio (Run2m), e uno in esecuzione 3 mesi, etichettato 2 mesi dopo l’inizio dell’esercizio (Run3m) (Figura 2A). Abbiamo osservato un grado simile di crescita neuronale in tutte le condizioni rispetto ai topi sedentari, il che indica che tutte le coorti neuronali nati nel cervello di un topo di mezza età in esecuzione volontaria subirà una rapida crescita e integrazione (Figure 2B,C). Gli alberi dendritici dei GC nei topi Run3m erano leggermente più lunghi di quelli dei topi Run1m o Run2m, suggerendo che la promozione dell’integrazione neuronale potrebbe rispondere a un meccanismo il cui effetto si accumula nel tempo. Tuttavia, 1 mese di corsa ha prodotto un effetto quasi massimo sullo sviluppo di GC.
Abbiamo quindi studiato gli effetti dell’esercizio nel cervello che invecchia sulle coorti neuronali nate una volta terminata l’attività. Abbiamo confrontato come l’esecuzione per 3-4 settimane influenza lo sviluppo di nuovi GCs nato proprio all’inizio (Run1m), alla fine (Run-1m), o 1 mese dopo la fine dell’esercizio (Run-2m; Figura 3A). Sorprendentemente, coorti neuronali nati all’inizio o alla fine del periodo di esecuzione ha risposto in modo simile (Figure 3B,C). Al contrario, le coorti nate 1 mese dopo la fine dell’esercizio (Run-2m) hanno mostrato solo un effetto sottile.
Per integrarsi completamente nel circuito, i GC stabiliscono connessioni eccitatorie glutamatergiche sulle cellule piramidali CA3 attraverso grandi MFBs, e reclutare inibizione feedforward GABAergic sulle cellule piramidali attraverso estensioni filopodiali che nascono da quei terminali (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Mentre l’analisi confocale non ha rivelato cambiamenti nella zona di MFBs dei neuroni nati a Run-1m o Run1m rispetto ai controlli, il numero di filopodia/MFBs è aumentato di ∼100% (Figure 3D,E). Questi risultati indicano che l’esercizio fisico aumenta specificamente la connettività dai nuovi GC sulla rete locale inibitoria (Trinchero et al., 2019).
Discussione
La neurogenesi adulta comporta una sequenza di complesse fasi di sviluppo che porta all’integrazione di nuove unità di elaborazione delle informazioni. Le cellule staminali neurali della zona subgranulare lasciano il loro stato di quiescenza per diventare cellule progenitrici neurali proliferanti che espandono la popolazione dei precursori (cellule amplificatrici di transito) (Bonaguidi et al., 2012). Le cellule progenitrici generano neuroni che migrano, si sviluppano e si integrano nel circuito. Durante questa finestra temporale estesa si verifica una marcata riduzione del pool neuronale a causa della morte cellulare apoptotica. L’esercizio volontario e l’EE costituiscono forti stimoli per aumentare la neurogenesi ippocampale adulta nei roditori per tutta la vita (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). La neurogenesi diminuisce nel cervello che invecchia, principalmente come conseguenza della riduzione della dimensione del pool di cellule progenitrici. Sia la corsa che l’EE possono contrastare la diminuzione della produzione neuronale riportata negli animali che invecchiano, agendo attraverso meccanismi diversi (Kempermann et al., 2010). La corsa agisce a due livelli per migliorare la neurogenesi: aumentando il tasso di proliferazione delle cellule progenitrici neurali (van Praag et al., 1999b, 2005; Cooper et al., 2018), e accelerando la maturazione e l’integrazione funzionale dei neuroni in sviluppo (Trinchero et al., 2017). EE aumenta la sopravvivenza e accelera anche la maturazione dei nuovi GC, ma non influenza la proliferazione (Trinchero et al., 2017, 2019).
La corsa promuove anche il ricablaggio della connettività neuronale e la modulazione delle proprietà intrinseche nei nuovi GC durante la prima settimana di sviluppo nei topi giovani-adulti (Sah et al., 2017). Abbiamo recentemente segnalato un periodo critico durante la seconda settimana di maturazione dei GCs negli animali che invecchiano, in cui EE induce la crescita dendritica e l’integrazione più veloce di nuovi neuroni nel circuito (Trinchero et al., 2019). Abbiamo chiesto qui se correre per 1 settimana in qualsiasi momento dello sviluppo di GCs avrebbe influenzato la loro integrazione, ma non ha trovato alcun effetto (Figura 1). L’intero periodo di corsa di 3 settimane era necessario per regolare la neurogenesi. La mancanza di modulazione a breve termine suggerisce un meccanismo mediato da fattori che devono accumularsi per esercitare cambiamenti degni di nota. È interessante notare che l’esercizio volontario esacerba la produzione di BDNF, che si accumula per settimane prima di raggiungere un livello di plateau che esercita azioni massime (Vecchio et al., 2018). Anche se le neurotrofine sono mediatori chiave, è plausibile che gli effetti osservati qui siano mediati da più meccanismi. L’esercizio fisico aumenta anche l’attività elettrica nel giro dentato, aumenta il flusso sanguigno e modula la neuroinfiammazione (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Il contributo di altri meccanismi richiede ulteriori studi.
Mostriamo qui che ∼3 settimane-vecchio GCs da topi anziani cronicamente esposti a una ruota in esecuzione (fino a 3 mesi) presentano un fenotipo completamente sviluppato con lunghe e complesse arborizzazioni dendritiche, simili a quelli di nuovi GCs generati in topi giovani adulti (Figura 2). GC maturi in topi giovani-adulti e di mezza età raggiungono lunghezza e complessità dendritica equivalente entro la fine dello sviluppo, paragonabile a GC di 3 settimane in topi anziani esposti a EE o in esecuzione (Piatti et al., 2011; Trinchero et al., 2017, 2019). Questa prova accumulata parla di una chiara accelerazione della velocità di maturazione evocata dalla corsa.
A livello di output neuronale, la corsa ha promosso la rapida crescita delle estensioni filopodiali ma non ha modificato la dimensione delle MBFs (Figure 3D,E). Questo risultato suggerisce che i nuovi GC si integrano rapidamente, ma il loro output potrebbe essere orientato verso l’attivazione di interneuroni GABAergici in CA3 (contattati da filopodi), piuttosto che le cellule piramidali contattate da MFBs (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). È sorprendente che EE abbia provocato un marcato aumento sia delle dimensioni delle MFBs che del numero di estensioni filopodiali nei topi che invecchiano, coerentemente con una modulazione più equilibrata dell’output neuronale (Trinchero et al., 2019). Noi ipotizziamo che i cambiamenti dovuti all’EE comportino un rimodellamento dipendente dall’attività di sinapsi specifiche che si rafforzano per la codifica di spunti spaziali (Nicoll e Schmitz, 2005; Holtmaat e Svoboda, 2009). Al contrario, la corsa può rappresentare uno stimolo generale per i nuovi GC a prepararsi a connettersi a obiettivi specifici quando la codifica diventa necessaria, conservando il tono inibitorio da interneuroni GABAergici che potrebbero agire come un meccanismo che limita l’attività postsinaptica fino a quando il nuovo GC è stato correttamente assemblato all’interno della rete circostante.
I nostri risultati indicano che il cervello che invecchia genera segnali neurogenici quando i topi continuano a correre per periodi prolungati (mesi). In questo contesto, le successive coorti neuronali nate nei topi che corrono si sviluppano e si integrano rapidamente, permettendo ai circuiti di invecchiamento di accumulare un numero sostanziale di nuovi neuroni (Figura 4). La continua incorporazione di nuovi GC con caratteristiche simili a quelle che si verificano nei topi più giovani si traduce in un ippocampo ringiovanito con neuroni che potrebbero essere innescati per rispondere alle esperienze future.
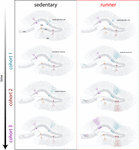
Figura 4. Ringiovanimento indotto dalla corsa della rete ippocampale nei topi di mezza età. Rappresentazione schematica del corso del tempo di integrazione neuronale in topi sedentari (sinistra) e in esecuzione (destra) dopo intervalli prolungati di esercizio volontario. Nella zona subgranulare del giro dentato, radial-glia come le cellule (RGL) rimangono in uno stato di quiescenza (in alto). Topi sedentari che invecchiano presentano bassi tassi di neurogenesi e nuovi neuroni si sviluppano in modo lento (coorti rappresentative sono indicate con colori diversi). Nei topi che corrono, la produzione di nuovi GC è potenziata, e queste nuove unità si sviluppano e si integrano più velocemente, espandendo la rete neurale in modo cumulativo su un arco di tempo esteso. In definitiva, queste nuove coorti di neuroni completamente maturi si impegnano a elaborare le informazioni su richiesta.
Da una prospettiva più ampia, l’aumento della longevità associato alla società moderna è accompagnato da un rischio maggiore per il declino cognitivo. Così, diventa rilevante per capire i meccanismi alla base dei ben noti benefici di esercizio nella funzione del cervello. Inoltre, ci potrebbero essere differenze a lungo termine tra gli individui che praticano l’esercizio durante diversi intervalli nella vita e quelli che hanno eseguito l’esercizio in modo continuo, in termini di diminuzione del rischio di sviluppare malattie neurodegenerative (Llorens-Martin, 2018). I nostri risultati dimostrano che la corsa continua promuove l’integrazione di molte coorti neuronali, elevando così la complessità della rete in modo notevole. Progettare diverse strategie per aumentare l’efficacia dell’integrazione di nuovi neuroni nell’ippocampo potrebbe servire come un promettente meccanismo di plasticità per migliorare alla fine il declino cognitivo che si verifica nel cervello sano e malato che invecchia. Infine, sezionare i meccanismi alla base dei diversi aspetti di tale integrazione e sviluppo neuronale accelerato ci insegnerà molto sul potenziale di plasticità delle reti neurali nel cervello che invecchia.
Data Availability
I dati che supportano i risultati di questo studio sono disponibili dall’autore corrispondente su richiesta ragionevole.
Dichiarazione etica
Lo studio sugli animali è stato rivisto e approvato dal comitato per l’uso e la cura degli animali da laboratorio dell’Istituto Leloir.
Contributi degli autori
MT e MH hanno eseguito gli esperimenti e analizzato i dati. MT, MH e AS hanno progettato gli esperimenti e scritto il manoscritto. AS ha fornito il supporto finanziario.
Finanziamento
Questo lavoro è stato sostenuto dall’Agenzia argentina per la promozione della scienza e della tecnologia (Grant# PICT2015-3814), il National Institute of Neurological Disorders and Stroke, e il Fogarty International Center (Grant# R01NS103758) a AS, che è investigatore nel Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT è stata sostenuta da una borsa di studio CONICET.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Acknowledgments
Ringraziamo i membri del laboratorio di AS per discussioni approfondite.
Acsady, L., Kamondi, A., Sik, A., Freund, T., e Buzsaki, G. (1998). Le cellule GABAergiche sono i principali obiettivi postsinaptici delle fibre muschiose nell’ippocampo di ratto. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Prove autoradiografiche e istologiche di neurogenesi ippocampale postnatale nei ratti. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015). L’ippocampo nell’invecchiamento e nella malattia: dalla plasticità alla vulnerabilità. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Un’ipotesi unificante sulle proprietà delle cellule staminali neurali dei mammiferi nell’ippocampo adulto. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Plasticità neurale nel cervello che invecchia. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Sinapsi senescenti e dinamiche del circuito ippocampale. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., e Moser, E. I. (2013). Memoria, navigazione e ritmo theta nel sistema ippocampale-entorinale. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). In fuga per la plasticità dell’ippocampo. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). L’esercizio fisico in età avanzata può migliorare la memoria e la funzione ippocampale? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenesi nell’ippocampo umano adulto. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., e Villeda, S. A. (2017). Meccanismi di invecchiamento ippocampale e il potenziale di ringiovanimento. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). Neurogenesi ippocampale adulto correla inversamente con microglia in condizioni di corsa volontaria e l’invecchiamento. Fronte. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., e Svoboda, K. (2009). Esperienza-dipendente plasticità sinaptica strutturale nel cervello dei mammiferi. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. Correre riduce lo stress e migliora la genesi delle cellule nei topi anziani. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. Perché e come l’attività fisica promuove la plasticità cerebrale indotta dall’esperienza. Fronte. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., e Gage, F. H. (1998). Neurogenesi indotta dall’esperienza nel giro dentato senescente. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., e Kempermann, G. (2006). Esercizio fisico impedisce declino legato all’età in attività delle cellule precursori nel giro dentato del mouse. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. Sottopopolazioni di cellule proliferanti dell’ippocampo adulto rispondono in modo diverso a stimoli neurogenici fisiologici. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). Neurogenesi nel giro dentato del ratto adulto: diminuzione legata all’età della proliferazione dei progenitori neuronali. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Esercitare nuovi neuroni per sconfiggere la malattia di Alzheimer. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Correre per tutta la mezza età migliora la funzione di memoria, neurogenesi ippocampale, e livelli di BDNF in topi C57BL/6J femmina. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. Neurogenesi ippocampale non è richiesto per gli effetti comportamentali di arricchimento ambientale. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). La neurogenesi ippocampale adulta è abbondante nei soggetti neurologicamente sani e cala bruscamente nei pazienti con malattia di Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., e Schinder, A. F. (2008). Cellule di granulo neonato nel giro dentato invecchiamento. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., e Schmitz, D. (2005). Plasticità sinaptica alle sinapsi delle fibre muscose dell’ippocampo. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). L’esposizione a lungo termine del tapis roulant protegge dal cambiamento neurodegenerativo legato all’età nell’ippocampo del ratto. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., e Franklin, K. B. J. (2001). Il cervello del topo in coordinate stereotassiche. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). La tempistica per la maturazione neuronale nell’ippocampo adulto è modulata dall’attività di rete locale. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., e Frankland, P. W. (2015). Sviluppo della connettività cellulare generata dall’adulto con popolazioni di cellule eccitatorie e inibitorie nell’ippocampo. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., e van Praag, H. (2017). In esecuzione riorganizza il circuito di una settimana-vecchio neuroni ippocampali nati adulti. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., e Ormerod, B. K. (2013). Esercizio quotidiano migliora la memoria, stimola la neurogenesi ippocampale e modula le citochine immunitarie e neuroimmuni nei ratti invecchiamento. Cervello Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. Ricostruzione senza soluzione di continuità di intatti neuroni adulti-nati da serie di imaging end-block rivela guida assonale complesso e lo sviluppo nell’ippocampo adulto. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. Neuroni nati nel giro dentato adulto formare sinapsi funzionali con le cellule bersaglio. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Alta plasticità di nuove cellule di granuli nell’ippocampo di invecchiamento. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., e Schinder, A. F. (2019). Plasticità strutturale dipendente dall’esperienza dei neuroni nati da adulti nell’ippocampo che invecchia. Fronte. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). Correre migliora la neurogenesi, l’apprendimento e il potenziamento a lungo termine nei topi. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). Correre aumenta la proliferazione cellulare e la neurogenesi nel giro dentato del topo adulto. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., e Gage, F. H. (2005). Esercizio migliora l’apprendimento e la neurogenesi ippocampale in topi anziani. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., e Aubert, I. (2018). Gli effetti neuroprotettivi dell’esercizio fisico: mantenere un cervello sano durante l’invecchiamento. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. Esercizio migliora la proliferazione delle cellule staminali neurali e la crescita dei neuriti e la sopravvivenza delle cellule progenitrici neuronali nel giro dentato di topi di mezza età. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., e Hen, R. (2015). Correre rescues un deficit di discriminazione contestuale basato sulla paura in topi invecchiati. Front. Sistema. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Il miglioramento della memoria indotta dalla corsa correla con la conservazione delle spine sottili nell’area ippocampale CA1 di vecchi topi C57BL/6. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




