Frontiers in Pharmacology
Introduzione
L’olanzapina è uno degli antipsicotici di seconda generazione (SGA) più usati per la schizofrenia, il disturbo bipolare e i sintomi psicotici. Oltre a migliorare i principali sintomi della psicosi, l’olanzapina mostra una grande accettabilità, diminuisce l’interruzione per tutte le cause e previene le ricadute future (Leucht et al., 2009). Molti studi clinici randomizzati (RCT) e meta analisi hanno suggerito che l’olanzapina è uno dei farmaci antipsicotici più efficaci nei pazienti con schizofrenia (Leucht et al., 2013; Huhn et al., 2019).
Gli effetti avversi più comuni di olanzapina sono l’aumento di peso (Allison et al., 1999). L’olanzapina provoca il maggior aumento di peso degli SGA. Lo studio Comparison of Atypicals for First Episode (CAFE) ha dimostrato che l’80% dei pazienti trattati con olanzapina ha guadagnato più del 7% del loro peso corporeo iniziale alla settimana 52 (McEvoy et al., 2007). Il tasso di interruzione dell’olanzapina a causa dell’aumento di peso o degli effetti metabolici di accompagnamento è stato 2-8 volte superiore a quello di altri antipsicotici nello studio Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) (Lieberman et al., 2005). Oltre ad essere associato ad una minore aderenza al trattamento farmacologico, l’aumento di peso è anche associato ad una sostanziale morbilità e mortalità medica. Considerando l’alto tasso di obesità nei pazienti con schizofrenia (42%), il rischio potenziale di aumento di peso indotto dall’olanzapina dovrebbe essere valutato attentamente (Newcomer, 2006). Alcuni studi randomizzati controllati (RCT) hanno scoperto che i pazienti con malattie mentali muoiono fino a 30 anni prima rispetto alla popolazione generale (Das-Munshi et al., 2017). La principale causa di morte in questa popolazione è la malattia cardiaca. Un importante fattore di rischio per le malattie cardiache e la morte prematura in questi pazienti è l’aumento di peso (Fekadu et al., 2015).
I meccanismi alla base dell’aumento di peso indotto dagli antipsicotici e degli effetti metabolici avversi non sono ben compresi (Correll et al., 2011). L’olanzapina è associata a un elevato appetito e assunzione di cibo e a una diminuzione dell’attività o a una compromissione della regolazione metabolica (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. hanno riferito che negli uomini sani, l’olanzapina ha aumentato il peso corporeo attraverso un aumento dell’assunzione di cibo, senza evidenza di una diminuzione dell’attività o dei livelli di spesa (Fountaine et al., 2010). Questa osservazione è in accordo con le osservazioni su pazienti maschi adolescenti ricoverati con schizofrenia (Gothelf et al., 2002). I pazienti avevano un indice di massa corporea significativamente aumentato a causa di un maggiore apporto calorico dopo 4 settimane di trattamento con olanzapina (Gothelf et al., 2002). Tuttavia, le prove attuali riguardanti l’associazione dell’appetito con l’aumento di peso sono inconcludenti (Poyurovsky et al., 2007; Case et al., 2010). Case et al. hanno riferito che i cambiamenti precoci dell’appetito non erano coerentemente correlati al cambiamento complessivo del peso in quattro diversi studi (Case et al., 2010). Inoltre, nessuno studio ha riportato il momento esatto dell’aumento dell’appetito, ha confrontato la velocità dell’aumento di peso rispetto al momento dell’aumento dell’appetito o ha valutato le differenze nell’aumento di peso e negli effetti metabolici tra i pazienti con appetito aumentato o invariato. Pertanto, abbiamo valutato l’associazione tra l’aumento dell’appetito e i cambiamenti di peso indotti dall’olanzapina e gli effetti metabolici di accompagnamento nei pazienti al primo episodio di schizofrenia naïve ai farmaci.
Materiali e metodi
Partecipanti
Questo studio è stato condotto presso il Mental Health Institute of the Second Xiangya Hospital, Central South University, Cina tra dicembre 2016 e aprile 2019. I partecipanti sono stati valutati per la schizofrenia secondo i criteri definiti dal Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013). Poiché i pazienti naïve agli antipsicotici o al primo episodio sembrano aumentare di peso dopo il trattamento con olanzapina (Correll et al, 2011), abbiamo incluso in questo studio i pazienti al primo episodio di schizofrenia di età compresa tra i 18 e i 50 anni.
I criteri di esclusione includevano (i) risultati clinicamente anormali di esami fisici, test di laboratorio o risultati di elettrocardiogramma (ECG); (ii) disturbi come disabilità intellettuale, disturbo da uso di sostanze o alcol, una diagnosi di altre malattie sistemiche specifiche secondo i criteri DSM-5; (iii) malattie cardiovascolari e metaboliche come il diabete mellito, la dislipidemia e l’ipertensione; (iv) una storia di disturbi alimentari; (v) dieta rigida nel mese precedente lo screening o durante lo studio; e (vi) gravidanza o allattamento.
Intervento
Studi precedenti hanno suggerito che il tasso di aumento di peso indotto da olanzapina era più rapido durante le prime 12 settimane di trattamento (Correll et al., 2009). Pertanto, i partecipanti sono stati trattati con olanzapina (15-20 mg/giorno alle 20:00) per 12 settimane. La dose iniziale di olanzapina era di 5 mg/giorno e poi regolata a 15-20 mg/giorno nella prima settimana.
Valutazione
Le valutazioni di base includevano dati demografici, un’anamnesi completa, misure antropometriche (peso e altezza), appetito, esame fisico e analisi di laboratorio. L’appetito è stato valutato ogni giorno, 30 minuti prima del pranzo, con quattro domande standardizzate: Fame, sensazione di sazietà, pensieri sul cibo e sovralimentazione. Le risposte sono state valutate su una scala da 0 a 10, dove 0 = “per niente” e 10 = “estremamente”. L’aumento dell’appetito è stato definito come un aumento >10% nei punteggi di appetito basali. La diminuzione dell’appetito è stata definita come una diminuzione >10% nei punteggi di appetito basali. La Positive and Negative Syndrome Scale (PANSS) è stata utilizzata per valutare la gravità dei sintomi della schizofrenia. Gli effetti avversi sono stati valutati dalla Treatment Emergent Symptom Scale (TESS). Ad ogni visita di follow-up, tutte le valutazioni di base (compreso l’esame fisico, le misure antropometriche, l’appetito e la TESS) sono state ripetute, tranne la PANSS. La PANSS è stata rivalutata alla settimana 12.
Prima del trattamento e nello stato di digiuno, il peso e l’altezza sono stati misurati dopo che i partecipanti hanno rimosso le scarpe con abiti leggeri interni. L’appetito è stato valutato prima del pranzo e si è basato sul giudizio del medico valutatore il giorno dell’esame. Gli esami di laboratorio, tra cui il glucosio plasmatico, la funzione epatica e renale sono stati valutati utilizzando procedure enzimatiche con l’analizzatore chimico automatizzato Boehringer Mannheim/Hitachi 714. L’insulina è stata misurata con un test immunoenzimatico in fase solida (ELISA).
I risultati primari erano la percentuale di pazienti che avevano aumentato l’appetito e il periodo di tempo tra il trattamento con olanzapina e l’aumento dell’appetito. I risultati secondari includevano cambiamenti di peso, indice di massa corporea (BMI), glucosio a digiuno, insulina a digiuno e indice di resistenza all’insulina, profili lipidici che includevano trigliceridi, colesterolo, lipoproteine ad alta densità (HDL-C), e lipoproteine a bassa densità (LDL-C), e punteggio PANSS. Il BMI è stato calcolato secondo i criteri del Working Group on Obesity in China: peso sano (18,5 ≤ BMI <25 kg/m2), sovrappeso (25 ≤ BMI ≤ 28 kg/m2), e obeso (BMI > 28 kg/m2). La dislipidemia è stata definita come colesterolo ≥ 5,18 mmolċl-1, trigliceridi ≥ 1,70 mmolċl-1, HDL-C < 1,04 mmolċl-1, o LDL-C ≥ 3,37 mmolċl-1 in base alle linee guida cinesi per la dislipidemia (Hu, 2017). Un’analisi della proporzione di pazienti che hanno guadagnato più del 7% del loro peso corporeo basale dopo 12 settimane, che è il cutoff per l’aumento di peso clinicamente significativo, è stato anche incluso (Kanders et al., 1991).
Analisi statistica
Statistical Package for Social Sciences, versione 25.0 (SPSS v25.0) è stato impiegato per le analisi statistiche. Le variabili continue e le variabili categoriche sono state descritte usando statistiche riassuntive (medie e deviazioni standard) o frequenze e percentuali, rispettivamente. Le analisi t-test e chi-quadro di Student sono state utilizzate per analizzare le differenze tra i gruppi nei cambiamenti di peso corporeo, BMI, glucosio e insulina a digiuno, indice di resistenza all’insulina, trigliceridi, colesterolo, HDL-C e LDL-C dal basale ad ogni punto temporale. Abbiamo studiato l’associazione tra peso, BMI, indice di resistenza all’insulina, LDL-C e appetito utilizzando l’analisi di regressione lineare. Un valore P (p) < 0,05 è stato considerato statisticamente significativo.
Risultati
In totale, 33 pazienti schizofrenici (età media, 23,5 anni; range 18-36 anni) sono stati arruolati nello studio. C’era una proporzione più alta di pazienti di sesso femminile (63,6%, 21/33). Tutti i pazienti erano nel range di BMI normale (BMI medio, 21,3 ± 1,7 kg/m2). La durata media della schizofrenia era di 11,2 ± 3,7 (range 5-18) mesi. Due pazienti donne hanno abbandonato lo studio dopo 4 settimane a causa dell’aumento dell’appetito; i restanti 31 (93,9%) partecipanti hanno completato lo studio (tabella 1).
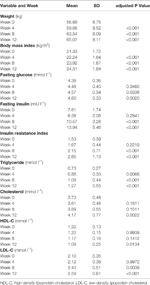
Tabella 1 Riassunto delle misure di peso e metaboliche per studio.
Aumento dell’appetito dopo il trattamento con olanzapina
Dopo 12 settimane di trattamento con olanzapina, il 77,4% (24/31) dei pazienti ha avuto un aumento dell’appetito e il 22,6% (7/31) un appetito invariato. Come mostrato nella Figura 1, per i 24 pazienti che hanno avuto un aumento dell’appetito, l’aumento dell’appetito è iniziato entro le prime 8 settimane di trattamento con olanzapina ed è durato fino alla fine del trattamento. Il tempo medio dall’inizio del trattamento con olanzapina all’aumento dell’appetito è stato di 20,3 giorni (SD = 14,4), e il 25,0% (6/24) e il 70,8% (17/24) hanno aumentato l’appetito entro 1 settimana e 4 settimane, rispettivamente. Due pazienti hanno aumentato l’appetito il 3° giorno dopo il trattamento con olanzapina. Nessuna differenza significativa è stata trovata nell’appetito indotto dall’olanzapina tra i diversi generi usando l’analisi ANOVA a due vie.
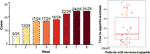
Figura 1 Numero di pazienti con aumento dell’appetito durante 8 settimane di trattamento con olanzapina.
Cambiamenti di peso corporeo e BMI dopo il trattamento con olanzapina
Significativi aumenti di peso e BMI sono stati osservati dopo il trattamento con olanzapina (Tabella 1). L’aumento di peso medio è stato di 7,9 kg durante il periodo di 12 settimane di trattamento con olanzapina, con pazienti che hanno guadagnato 2,4, 4,0 e 1,5 kg rispettivamente al primo, secondo e terzo periodo di 4 settimane. I pazienti di sesso femminile avevano maggiori probabilità di aumentare di peso (P < 0,001), con un aumento di peso medio di 9,19 kg durante il periodo di studio rispetto all’aumento di peso di 5,90 kg nei pazienti maschi. Sul totale dei pazienti, l’80,6% (25/31) e il 61,3% (19/31) hanno aumentato il loro peso corporeo iniziale di oltre il 7% e il 10%, rispettivamente, durante le 12 settimane di trattamento con olanzapina (tabella 1 supplementare). Dopo 12 settimane, il 51,6% (16/31) dei pazienti è diventato sovrappeso (BMI>25 kg/m2).
Cambiamenti dei disturbi metabolici dopo il trattamento con olanzapina
Significativi aumenti di glucosio a digiuno, insulina a digiuno, indice di insulino-resistenza, trigliceridi, colesterolo e LDL-C e diminuzioni di HDL-C sono stati osservati a 12 settimane (Tabella 1). Nessun paziente incluso nello studio aveva dislipidemia al basale. In base alle linee guida cinesi per la dislipidemia, il 38,7% (12/31) dei pazienti aveva dislipidemia dopo 12 settimane di trattamento con olanzapina.
Aumento dell’appetito e aumento di peso indotto da olanzapina
Al fine di rilevare l’effetto dell’aumento dell’appetito sull’aumento di peso indotto da olanzapina, abbiamo diviso i pazienti in due gruppi (gruppo con aumento dell’appetito e gruppo con appetito invariato) in base all’aumento o meno dell’appetito dopo 12 settimane di trattamento con olanzapina.
Rispetto al gruppo con appetito invariato, c’erano aumenti significativi del peso e dei livelli di BMI nel gruppo con aumento dell’appetito dopo 12 settimane di trattamento con olanzapina (tabella 2). La figura 2 ha mostrato il confronto tra l’aumento di peso e gli esiti legati al metabolismo tra i gruppi con aumento dell’appetito e quelli con appetito invariato. Le analisi dettagliate sono state presentate nella Tabella 2 supplementare. L’aumento di peso tra i due gruppi era significativo (P = 0,01) usando l’analisi ANOVA a due vie. Il peso medio è aumentato di 9,1 kg (SD = 4,1) nel gruppo con aumento dell’appetito e di 3,9 kg (SD = 2,0) nel gruppo con appetito invariato, con una differenza significativa tra i due gruppi durante le 12 settimane di trattamento con olanzapina. Una percentuale maggiore di pazienti (91,7%) nel gruppo con aumento dell’appetito ha guadagnato più del 7% del loro peso corporeo iniziale dopo 12 settimane rispetto ai pazienti nel gruppo con appetito invariato (42,9%; χ2 = 8,27, df = 1, p = 0,004). Allo stesso modo, più pazienti nel gruppo appetito aumentato (19/24, 79.2%) hanno guadagnato più del 10% del peso corporeo iniziale dopo 12 settimane rispetto ai pazienti nel gruppo appetito invariato (0.0%; χ2 = 14.32, df = 1, p < 0.001) (Tabelle supplementari 3-5). Dopo 12 settimane di trattamento con olanzapina, il 58,3% dei pazienti è diventato sovrappeso nel gruppo con aumento dell’appetito rispetto al 28,6% dei pazienti nel gruppo con appetito invariato. L’aumento dell’appetito ha fortemente mediato l’aumento di peso indotto dall’olanzapina con un effetto mediatore del 66,2%.

Tabella 2 Statistiche descrittive delle misure di risultato tra i gruppi con appetito aumentato e invariato al basale e alle settimane 4, 8 e 12.
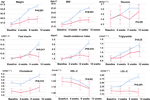
Figura 2 Confronto del peso corporeo, BMI, glucosio e livelli lipidici tra i gruppi con aumento dell’appetito e invariato. La linea blu indica i pazienti con aumento dell’appetito; la linea rossa indica i pazienti con appetito invariato.
Aumento dell’appetito e disturbi metabolici indotti dall’olanzapina
C’erano differenze significative in insulina (p = 0.017), indice di resistenza all’insulina (p = 0.015) e LDL-C (p = 0.001) tra l’aumento dell’appetito e i gruppi invariati dopo 12 settimane (Figura 2 e Tabella 2). Quattro pazienti nel gruppo con aumento dell’appetito avevano colesterolo ≥ 5,18 mmolċl-1, nove avevano trigliceridi ≥ 1,70 mmolċl-1, sei avevano HDL-C < 1,04ċmmol l-1, e tre avevano LDL-C ≥ 3,37 mmolċl-1 alla settimana 12. In totale, 13/24 pazienti nel gruppo con aumento dell’appetito avevano dislipidemia dopo 12 settimane, mentre nessuno dei pazienti nel gruppo con appetito invariato ha sviluppato dislipidemia durante il periodo di studio (Tabella 3).

Tabella 3 Dislipidemia definita da ogni singola misura di risultato nei gruppi con aumento dell’appetito e invariato.
Il picco di aumento di peso raggiunto 1 mese dopo il mese di aumento dell’appetito
Nel gruppo di aumento dell’appetito, abbiamo analizzato l’aumento di peso medio per ogni paziente in quattro punti temporali: prima del mese di tempo di aumento dell’appetito (-1M), il mese di tempo di aumento dell’appetito (0M), un mese dopo l’aumento dell’appetito (+1M), e due mesi dopo l’aumento dell’appetito (+2M). Rispetto a -1M, c’è stato un aumento dell’aumento di peso a 0M, ma questo cambiamento non era significativo (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). L’aumento di peso è entrato nel picco di crescita a +1M, con un 4,3 ± 2.4 kg di aumento. La crescita del peso è decelerata a +2M (p < 0,001) di 1,6 ± 1,5 kg. L’aumento di peso a +2M ha rallentato e si è stabilizzato, e non sono state osservate differenze significative rispetto a -1M (Figura 3 e Tabella 6 supplementare).
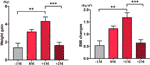
Figura 3 Velocità media di aumento di peso nel gruppo con aumento dell’appetito. L’aumento di peso medio per ogni paziente al mese durante il periodo di studio è stato analizzato in quattro punti temporali: prima del mese di tempo di aumento dell’appetito (-1M), il mese di tempo di aumento dell’appetito (0M), 1 mese dopo il mese di tempo di aumento dell’appetito (+1M), e 2 mesi dopo il mese di tempo di aumento dell’appetito (+2M). ** indica P < 0,01, *** indica P < 0,001.
L’aumento dell’appetito anticipato predice un maggiore aumento di peso in 1 mese dopo il mese di aumento dell’appetito
Abbiamo confrontato ulteriormente la velocità di aumento del peso dei partecipanti con aumento dell’appetito entro 4 settimane (A) e dei partecipanti con un aumento dell’appetito tra 4 e 8 settimane (B). A 0M, le velocità di aumento del peso tra i partecipanti con un aumento dell’appetito entro 4 settimane e i partecipanti con un aumento dell’appetito tra 4 e 8 settimane non erano significativamente diverse. Tuttavia, i partecipanti con un aumento dell’appetito precedente hanno mostrato una velocità di aumento del peso significativamente maggiore a +1M. Questi risultati hanno dimostrato che un aumento dell’appetito più precoce potrebbe portare a un maggiore aumento di peso durante il periodo di follow-up (Figura 4). Cambiamenti simili nel BMI sono stati osservati durante i quattro punti di tempo (Figure 3 e 4).
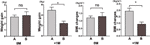
Figura 4 Confronto della velocità di aumento del peso dei partecipanti con aumento dell’appetito in diversi mesi. Abbiamo confrontato la velocità di aumento di peso dei partecipanti con aumento dell’appetito entro 4 settimane (A) e partecipanti con un aumento dell’appetito tra 4 e 8 settimane (B) nel mese di tempo di aumento dell’appetito (0M) e 1 mese dopo il mese di tempo di aumento dell’appetito (+1M). ns, indica non significativo, * indica P < 0.05.
Appetito e velocità dei cambiamenti del disturbo metabolico
Dati descrittivi dettagliati per i cambiamenti nel peso, BMI, glucosio a digiuno, insulina, indice di resistenza all’insulina, trigliceridi, colesterolo, HDL-C e LDL-C sono riassunti nella tabella 2 Per studiare l’associazione tra aumento dell’appetito e metabolismo di glucosio e lipidi, abbiamo analizzato i cambiamenti in questi indicatori a quattro punti di tempo nel gruppo di aumento dell’appetito. Non sono stati osservati significativi cambiamenti di velocità per il glucosio, trigliceridi, HDL-C e LDL-C in qualsiasi punto temporale. Aumenti significativi nelle velocità dell’insulina e dell’indice di resistenza all’insulina sono stati osservati solo a +2M (Figura 1 supplementare e Tabella 6 supplementare). Ulteriori confronti hanno suggerito che i partecipanti con un aumento dell’appetito entro 4 settimane non hanno mostrato un aumento significativo della velocità dell’insulina e dell’indice di resistenza all’insulina a 0M e +1M rispetto ai partecipanti con un aumento dell’appetito tra 4 e 8 settimane (Figura supplementare 2).
La previsione dell’appetito sull’aumento di peso indotto dall’olanzapina e sui disturbi metabolici
Abbiamo condotto un’analisi di regressione lineare per valutare l’effetto dell’aumento dell’appetito sull’aumento di peso, sulla glicemia e sui livelli lipidici. Dopo aver controllato le variabili statisticamente significative come il sesso, l’età, l’altezza e la durata, abbiamo incluso nell’analisi di regressione l’aumento di peso, il BMI, il glucosio a digiuno, l’insulina, l’indice di resistenza all’insulina, i trigliceridi, il colesterolo, l’HDL-C e l’LDL-C come variabili dipendenti e l’appetito come variabile indipendente. L’aumento dell’appetito era associato ai cambiamenti di peso (β = 0,67, p = 0,0003), BMI (β = 0,63, p = 0,0004), insulina (β = 0,49, p = 0,019), indice di resistenza all’insulina (β = 0,51, p = 0,0149), e LDL-C (β = 0.61, p = 0.0035) (Tabella supplementare 7).
Significativi miglioramenti dal basale al punto finale dei sintomi clinici (valutati da PANSS, p < 0.001) sono stati osservati dopo il trattamento con olanzapina. Nessuna differenza significativa nel PANSS è stata osservata tra i gruppi con aumento dell’appetito e con appetito invariato (p > 0,05).
Effetti avversi
Tra tutti i 31 pazienti che hanno completato lo studio, nove (29.0%) pazienti hanno riportato ipoattività, otto (25,8%) pazienti hanno riportato sonnolenza, quattro (12,9%) pazienti hanno avuto un test epatico anormale, due (6,5%) pazienti hanno riportato acatisia, quattro (12,9%) pazienti hanno avuto costipazione, un (3.L’80,6% (25/31) dei pazienti ha aumentato il proprio peso corporeo di più del 7% durante il periodo di studio.
Discussione
In questo studio prospettico, i risultati principali hanno mostrato che il 77,4% dei pazienti ha aumentato l’appetito dopo il trattamento con olanzapina, e questi pazienti che hanno aumentato l’appetito hanno guadagnato più peso rispetto ai pazienti con appetito invariato (9,1 kg contro 3,9 kg). Allo stesso modo, un numero maggiore di pazienti nel gruppo con aumento dell’appetito ha aumentato il proprio peso corporeo iniziale di oltre il 7 o il 10%, suggerendo che l’aumento dell’appetito è associato a un sostanziale aumento di peso nei pazienti al primo episodio di schizofrenia in trattamento con olanzapina. Inoltre, l’analisi di regressione lineare ha anche sostenuto che l’aumento dell’appetito era fortemente correlato all’aumento di peso indotto dall’olanzapina. Questi risultati erano in accordo con i rapporti precedenti (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) hanno osservato un aumento dei livelli di grelina stimolante l’appetito e della percentuale di grasso corporeo in pazienti schizofrenici trattati con olanzapina. I risultati di uno studio randomizzato in doppio cieco hanno suggerito che l’olanzapina ha indotto il desiderio di cibo e le abbuffate in misura maggiore rispetto alla clozapina (Murashita et al., 2005; Kluge et al., 2007). Risultati simili sono stati riportati anche nei topi trattati con olanzapina (Cope et al., 2005). L’azione dell’olanzapina su più siti recettoriali, specialmente i recettori D2 e 5H3, che modulano l’appetito, è stata anche applicata nel trattamento dell’anoressia nervosa e della nausea e vomito indotti dalla chemioterapia (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
Abbiamo anche trovato che il 70,8% dei pazienti ha aumentato l’appetito entro le prime 4 settimane di trattamento iniziale con olanzapina con una media di 20,3 giorni di aumento. Alcuni pazienti hanno addirittura aumentato l’appetito già dal terzo giorno dopo il trattamento con olanzapina. È interessante notare che i pazienti i cui appetiti sono aumentati prima nel tempo hanno probabilmente guadagnato più peso rispetto ai pazienti i cui appetiti sono aumentati più tardi nel tempo, e l’aumento di peso ha raggiunto il picco 1 mese dopo l’aumento dell’appetito. Anche se non è stata trovata alcuna differenza significativa nell’appetito indotto dall’olanzapina tra maschi e femmine, i pazienti di sesso femminile avevano maggiori probabilità di aumentare di peso (P < 0,001). Pertanto, l’appetito dovrebbe essere considerato come un indicatore per prevedere l’aumento di peso indotto dall’olanzapina, soprattutto nelle pazienti donne. In ambito clinico, i medici dovrebbero prestare maggiore attenzione ai pazienti il cui appetito aumenta precocemente dopo il trattamento con olanzapina e dovrebbero iniziare un piano di prevenzione del peso.
I pazienti trattati con olanzapina hanno mostrato un aumento di oltre il 7% del peso corporeo iniziale, che è coerente con i risultati precedenti (Gothelf et al., 2002; Wu et al., 2008). Oltre a un significativo aumento di peso, i pazienti trattati con olanzapina avevano un metabolismo glucidico e lipidico significativamente perturbato dopo 12 settimane, il che è coerente con le osservazioni precedentemente pubblicate in pazienti con schizofrenia (Correll et al., 2011). Rispetto ai pazienti del gruppo con appetito invariato, il gruppo con appetito aumentato presentava significative anomalie lipidiche. Il glucosio a digiuno non era significativamente diverso tra i due gruppi. I partecipanti con un aumento iniziale dell’appetito non hanno mostrato un aumento della velocità dell’insulina e dell’indice di resistenza all’insulina nei mesi successivi all’aumento dell’appetito. È possibile che i livelli di glucosio siano indipendenti dall’aumento di peso, poiché l’appetito non ha influenzato i livelli di glucosio.
Gli esiti negativi per la salute fisica associati agli antipsicotici, come l’aumento di peso, i disturbi metabolici e la relativa morbilità, sono stati riconosciuti da tempo (Wu et al., 2016). Studi precedenti hanno suggerito che l’appetito può predire l’aumento di peso indotto dall’olanzapina e gli effetti metabolici avversi (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). A nostra conoscenza, questo è il primo studio a valutare l’associazione tra appetito, aumento di peso e disturbi metabolici dopo il trattamento con olanzapina in pazienti al primo episodio di schizofrenia naive ai farmaci. Alcuni risultati ci danno più evidenze su come scegliere ragionevolmente i farmaci nel lavoro clinico e danno più benefici per prevenire l’aumento di peso e i disturbi metabolici indotti dall’olanzapina.
Ci sono diverse limitazioni al nostro studio. In primo luogo, questo studio non ha misurato l’assunzione di cibo come pasti e spuntini, anche se tutti i pazienti inclusi sono stati forniti con lo stesso menu alimentare standardizzato. Un’elevata assunzione di grassi e fruttosio può diminuire il controllo dell’appetito influenzando la regolazione centrale dell’appetito. Infatti, le diete ad alto contenuto di fruttosio hanno effetti negativi sulla segnalazione dell’appetito centrale e sulla funzione cognitiva (Lowette et al., 2015; Dalvi et al., 2017). In secondo luogo, non abbiamo esaminato i livelli di leptina e grelina durante il periodo di studio. Secreti dal tessuto adiposo e dallo stomaco, rispettivamente, la leptina e la grelina svolgono ruoli cruciali nella regolazione dell’assunzione di cibo e del metabolismo energetico (Cui et al., 2017). Diversi studi hanno trovato un aumento del livello di leptina e una diminuzione del livello di grelina nelle prime settimane dopo l’inizio della terapia con olanzapina (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). L’aumento del livello di leptina rimane stabile per diverse settimane, ma il livello di grelina aumenta nel periodo più lungo (Sentissi et al., 2008). Ulteriori ricerche dovrebbero monitorare le risposte di leptina e grelina all’aumento dell’appetito, così come le loro relazioni con i parametri metabolici e gli effetti clinici. Inoltre, non abbiamo monitorato i livelli di attività durante il periodo di studio. Anche se alcuni studi hanno riportato che l’olanzapina ha aumentato il peso corporeo solo aumentando l’appetito e l’assunzione di cibo, senza differenze significative nella spesa energetica a riposo (Gothelf et al., 2002; Fountaine et al., 2010). Un certo numero di studi ha riportato una riduzione delle attività fisiche con la somministrazione di olanzapina (Perez-Cruzado et al., 2018). Nel nostro studio, il 29,0% dei pazienti ha riportato ipoattività e il 25,8% sonnolenza durante il periodo di trattamento con olanzapina di 12 settimane. Hillebrand et al. (2005) hanno scoperto che il trattamento con olanzapina ha ridotto l’attività fisica fisica nei ratti esposti all’anoressia basata sull’attività. Il trattamento con olanzapina ha anche ridotto i livelli di attività dei pazienti con anoressia nervosa, senza differenze significative di peso corporeo e livelli plasmatici di leptina rispetto ai pazienti non trattati. Il nostro studio precedente ha dimostrato che gli interventi sullo stile di vita, che includevano programmi psicoeducativi, dietetici e di esercizio fisico, possono ridurre l’aumento di peso indotto dagli antipsicotici (Wu et al., 2008). Inoltre, sarebbe meglio confrontare più pazienti con controlli sani di età simile, che possono aiutare a interpretare l’aumento dell’appetito indotto da olanzapina e i cambiamenti metabolici sono specificamente legati alle sue proprietà farmacologiche. Ulteriori studi dovrebbero concentrarsi sui meccanismi di aumento dell’appetito dopo il trattamento con olanzapina (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). Il sistema di ricompensa nelle regioni striatali può essere associato all’aumento di peso associato agli antipsicotici (Nielsen et al., 2016). L’attività alterata nella corteccia cingolata anteriore subgenuale può anche essere in parte alla base dell’aumento dell’appetito dopo il trattamento con olanzapina (Pawlowski et al., 2018). Studi di imaging dovrebbero essere eseguiti per indagare la modulazione dell’olanzapina dell’attività cerebrale profonda correlata all’appetito.
Conclusioni
In conclusione, il nostro studio ha dimostrato che l’appetito è correlato all’aumento di peso e alla dislipidemia indotta dall’olanzapina in pazienti al primo episodio di schizofrenia drug-naïve. La valutazione dei cambiamenti dell’appetito è un modo facile e pratico per la previsione dell’aumento di peso, che fornisce ai medici più tempo e opzioni per le strategie di intervento. Le prime invenzioni dietetiche volte a diminuire l’appetito e a ridurre l’assunzione di cibo possono essere utili per il controllo del peso nei pazienti schizofrenici trattati con olanzapina.
Data Availability Statement
I dataset generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Dichiarazione etica
Questo studio è stato eseguito in conformità con la Dichiarazione di Helsinki (Associazione G.A.o.t.W.M., 2013), e approvato dal Comitato Etico del Second Xiangya Hospital, Central South University. Dopo una descrizione completa dello studio ai partecipanti, è stato ottenuto il consenso informato prima della partecipazione allo studio.
Contributi degli autori
JH ha analizzato e interpretato i dati dei pazienti e ha contribuito principalmente alla stesura del manoscritto. G-RH ha principalmente progettato ed eseguito lo studio. YeY, C-CL, J-MX, Y-JL, e X-JP hanno aiutato nel reclutamento dei pazienti, nel monitoraggio della qualità dei dati e nel documentare gli eventi avversi emergenti dal trattamento. YiY ha aiutato a rivedere il manoscritto. J-PZ ha guidato il disegno dello studio. RR-W era responsabile del contenuto generale. Tutti gli autori hanno letto e approvato il manoscritto finale.
Finanziamento
Questo lavoro è stato sostenuto dal Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) e la National Nature Science Foundation of China (Grant No.81622018 e No. 81901401).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Vogliamo riconoscere il prezioso contributo dei partecipanti e il sostegno dei loro medici di base. Vogliamo anche ringraziare diversi revisori anonimi per i loro preziosi commenti e suggerimenti per migliorare la qualità dell’articolo.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Materiale supplementare Figura 1 | Velocità dei cambiamenti della glicemia e dei lipidi nel gruppo con aumento dell’appetito. I valori medi di cambiamento per ogni paziente per mese durante il periodo di studio è stato analizzato in quattro punti di tempo: prima del mese di tempo di aumento dell’appetito (-1M), il mese di tempo di aumento dell’appetito (0M), 1 mese dopo il mese di tempo di aumento dell’appetito (+1M) e 2 mesi dopo il mese di tempo di aumento dell’appetito (+2M).
Figura supplementare 2 | Confronto di insulina e insulino resistenza indice cambiamento velocità dei partecipanti con aumento di appetito in diversi mesi. Abbiamo confrontato la velocità dei partecipanti con un aumento dell’appetito entro 4 settimane (A) e dei partecipanti con un aumento dell’appetito tra 4-8 settimane (B) nel mese di tempo di aumento dell’appetito (0M) e 1 mese dopo il mese di tempo di aumento dell’appetito (+1M).
Tabella 1 | Numero di pazienti che avevano aumentato il peso corporeo iniziale di più di 7% o 10% alle settimane 4, 8 e 12.
Tabella 2 | Numero di pazienti che avevano aumentato il peso corporeo iniziale di più di 7% o 10% alle settimane 4, 8 e 12 in pazienti con aumento dell’appetito.
Tabella aggiuntiva 3 | Numero di pazienti che avevano aumentato il peso corporeo iniziale di più di 7% o 10% alle settimane 4, 8 e 12 in pazienti con appetito invariato.
Tabella aggiuntiva 4 | Confronto dei numeri di 7% o 10% di aumento di peso tra i pazienti con appetito aumentato e pazienti con appetito invariato alle settimane 4, 8 e 12.
Tabella 5 | L’analisi della velocità dell’aumento di peso medio, del glucosio e dei cambiamenti lipidici nel gruppo con aumento dell’appetito in quattro punti temporali: prima del mese di tempo di aumento dell’appetito (-1M), il mese di tempo di aumento dell’appetito (0M), 1 mese dopo il mese di tempo di aumento dell’appetito (+1M) e 2 mesi dopo il mese di tempo di aumento dell’appetito (+2M). ns indica non significativo, * indica p-value < 0.05, ** indica p-value < 0.01, *** indica p-value < 0.001.
Tabella 6 | Stime degli effetti dell’appetito sull’aumento di peso e sulle misure di risultato legate al metabolismo dal modello misto lineare generale controllando per età, durata della malattia e sesso.
Tabella 7-1 | I cambiamenti di peso, BMI, insulina, IRI, e LDL-C per paziente durante il periodo di trattamento in diversi gruppi.
Tabella 7-2 | Stime degli effetti dell’appetito sull’aumento di peso e sulle misure di risultato legate al metabolismo.
Abbreviazioni
SGAs, Antipsicotici di seconda generazione; RCT, Studio clinico randomizzato; CAFÉ, The Comparison of Atypicals for First Episode; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition; ECG, elettrocardiogramma; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked immunosorbent assays; BMI, Body mass index; HDL-C, High-density lipoprotein; LDL-C, Low-density lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Aumento di peso indotto da antipsicotici: una sintesi completa della ricerca. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Associazione, A.P. (2013). Manuale diagnostico e statistico dei disturbi mentali (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). livelli di grelina, colecistochinina, visfatina, leptina e proteina agouti correlata durante il trattamento di 6 settimane con olanzapina in pazienti maschi al primo episodio di psicosi. Int. Clin. Psicofarmacolo. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). Il ruolo potenziale dell’appetito nel predire i cambiamenti di peso durante il trattamento con olanzapina. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Aumento di peso indotto da farmaci antipsicotici: sviluppo di un modello animale. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Rischio cardiometabolico di farmaci antipsicotici di seconda generazione durante il primo utilizzo nei bambini e negli adolescenti. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Farmaci antipsicotici e l’obesità. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). Le basi cellulari e molecolari della resistenza alla leptina e alla grelina nell’obesità. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Alto grasso induce l’infiammazione acuta e cronica nell’ipotalamo: effetto della dieta ad alto contenuto di grassi, palmitato e TNF-alfa sull’appetito-regolazione dei neuroni NPY. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnia e eccesso di mortalità nella malattia mentale grave: uno studio di coorte. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Eccesso di mortalità nella malattia mentale grave: 10 anni studio di coorte basato sulla popolazione in Etiopia rurale. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Aumento dell’assunzione di cibo e del dispendio energetico dopo la somministrazione di olanzapina a uomini sani. Obesità 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
Associazione G.A.o.t.W.M. (2013). World Medical Association Dichiarazione di Helsinki: principi etici per la ricerca medica che coinvolge soggetti umani. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. Aumento di peso associato a un aumento dell’assunzione di cibo e a bassi livelli di attività abituale in pazienti schizofrenici adolescenti maschi trattati con olanzapina. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Meccanismi fisiopatologici dell’aumento del rischio cardiometabolico nelle persone con schizofrenia e altre gravi malattie mentali. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapina riduce l’attività fisica nei ratti esposti all’anoressia basata sull’attività: possibili implicazioni per il trattamento dell’anoressia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Nuove linee guida ed evidenze per la prevenzione e il trattamento della dislipidemia e della malattia cardiovascolare aterosclerotica in Cina. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Efficacia comparativa e tollerabilità di 32 antipsicotici orali per il trattamento acuto degli adulti con schizofrenia multiepisodica: una revisione sistematica e una meta-analisi di rete. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Uno studio pilota controllato con placebo di olanzapina aggiuntiva per adolescenti con anoressia nervosa. J. Child Adolesc. Psicofarmacolo. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Metodi nell’obesità. Terapia corrente di Conn. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapina e olanzapina sono associati con il desiderio di cibo e abbuffate: risultati di uno studio randomizzato in doppio cieco. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. L’associazione del peptide appetitivo acetilato grelina con desiderio di alcol in individui dipendenti dall’alcol in astinenza precoce. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Farmaci antipsicotici di seconda generazione contro quelli di prima generazione per la schizofrenia: una meta-analisi. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. Efficacia comparativa e tollerabilità di 15 farmaci antipsicotici nella schizofrenia: una meta-analisi di trattamenti multipli. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. Efficacia dei farmaci antipsicotici nei pazienti con schizofrenia cronica. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Effetti delle diete ad alto contenuto di fruttosio sulla segnalazione dell’appetito centrale e la funzione cognitiva. Fronte. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Effetti differenziali di olanzapina e clozapina sui livelli plasmatici di adipocitochine e grelina totale. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). I cambiamenti negli ormoni regolatori dell’appetito in seguito all’assunzione di cibo sono associati a cambiamenti nell’appetito riferito e a una misura del mangiare edonico in ragazze e giovani donne con anoressia nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. Efficacia e tollerabilità di olanzapina, quetiapina e risperidone nel trattamento delle psicosi precoci: un confronto randomizzato in doppio cieco di 52 settimane. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. L’olanzapina aumenta il livello di grelina nel plasma in pazienti con schizofrenia. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Rischio medico in pazienti con disturbo bipolare e schizofrenia. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Attività di ricompensa striatale e cambiamento di peso associato agli antipsicotici nei pazienti con schizofrenia in trattamento iniziale. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Indagine del meccanismo di aumento dell’appetito dopo Olanzapina da sLORETA durante il sonno. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Farmaci e attività fisica e forma fisica nella malattia mentale grave. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Effetto attenuante della reboxetina sull’appetito e sull’aumento di peso in pazienti schizofrenici trattati con olanzapina: uno studio in doppio cieco controllato con placebo. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. Un confronto degli effetti di olanzapina e risperidone rispetto al placebo sui comportamenti alimentari. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Livelli di leptina e grelina in pazienti con schizofrenia durante diversi trattamenti antipsicotici: una revisione. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. Cambiamenti neurali associati con l’elaborazione delle informazioni di appetito in pazienti schizofrenici dopo 16 settimane di trattamento con olanzapina. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Ruolo soppressivo dell’appetito dei neuroni glutammatergici del setto mediale. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Ricerca clinica di Olanzapina per la prevenzione della nausea e del vomito indotti dalla chemioterapia. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Intervento sullo stile di vita e metformina per il trattamento dell’aumento di peso indotto da antipsicotici: uno studio controllato randomizzato. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Trattamento con metformina della dislipidemia indotta da antipsicotici: un’analisi di due studi randomizzati e controllati con placebo. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




