3.3: 素粒子-電子、陽子、中性子
素粒子の識別と位置確認
1897年、イギリスの物理学者J・J・トムソン(1856-1940)は、原子が物質の最も基本的な形態ではないことを証明しました。 彼の実験は、陰極線管(CRT)を使用したものでした。 真空の環境下で、陰極から陽極に向かう目に見えない光線を発生させる装置である。 トムソンは、このブラウン管が磁場や電場によって曲げられることを実験的に示し、ブラウン管が荷電粒子で構成されていることを明らかにした。 さらに重要なことは、さまざまな強さの磁場や電場で陰極線がどの程度たわむかを測定することによって、粒子の質量電荷比を計算することができたことである。 同種の電荷は反発し合い、反対の電荷は引き合うので、トムソンは粒子が正味で負の電荷を持っていると結論付けたのである。
1910年代、X線の実験により、ある元素の原子の原子核にある正の電荷の大きさは同じである、という有用な結論が導き出されました。 つまり、同じ元素の原子はすべて同じ数の陽子をもっているのです。 さらに、元素によって原子核に含まれる陽子の数は異なるので、原子核に含まれる陽子の数が元素の特徴になるのです。 この発見は原子を理解する上で非常に重要であり、原子の原子核に含まれる陽子の数を原子番号と呼ぶことにしました。 これらの実験を行ったのは、アーネスト・ラザフォードである。
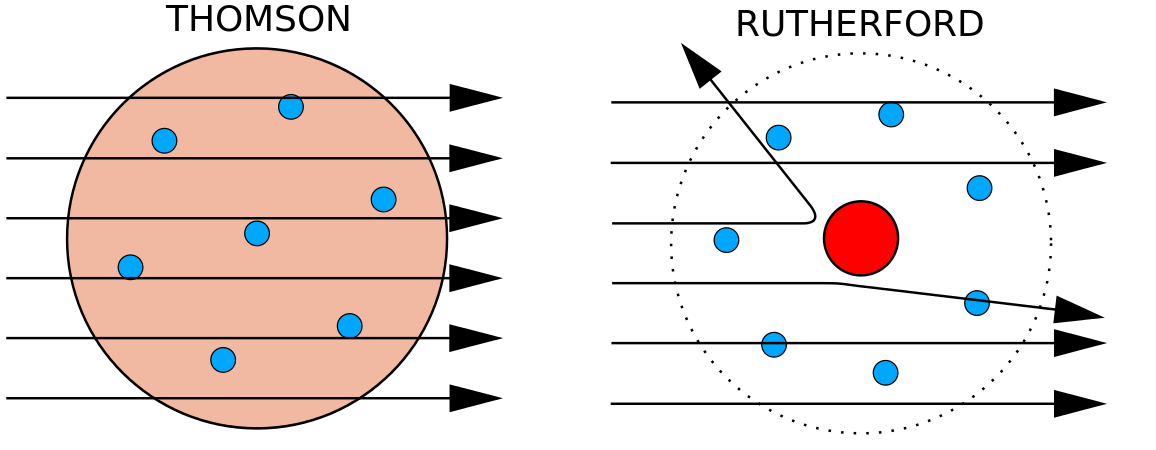
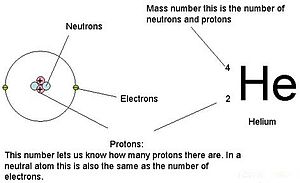
ラザフォードは陽子がこの領域の中にあることを認識していたのである。 アーネスト・ラザフォードの同僚の一人、ジェイムズ・チャドウィックは、ベリリウムの放射性反応を行い、研究していた。 アルファ粒子をベリリウムの原子核にぶつけると、中性子粒子が放出される。 1932年、チャドウィックは第3の素粒子である中性子の存在を発表した。 この粒子は質量が1原子質量単位で、電荷をもたない。 この発見によって、原子力の科学と技術が一気に始まった。 ここに描かれているヘリウムなどの元素は、原子が集まってできています。 原子は原子核の中にある陽子と中性子、原子核を取り巻く軌道にある電子で構成されています。
3つの素粒子の質量はamu(原子質量単位)とグラムで表すことができます。 簡単のために、3つの素粒子の単位はamuを使うことにする。 中性子も陽子も質量はそれぞれ1amuとして割り当てられている。 一方、電子の質量は0.0005amuとごくわずかです。 この素粒子の質量は、周期表で表示される10進数の質量には表されていない。 7343>
en:User:Materialscientist)
原子(中性種)は、電子の数が陽子の数と等しくなります。 その結果、すべての原子は全体の電荷が0になる。 イオン(電子を獲得または喪失する原子)については、この章の後半を参照してください。 中性子と質量の値が表と異なる原子を同位体と呼びます。 このような特殊な種は、本文の次の部分で見ることができます。
| 素粒子 | 記号 | 相対電荷 | 位置 | アミュ質量 |
|---|---|---|---|---|
| 陽子p | +1 | 原子核の内側 | 1 | |
| 中性子n | 0 | 1 | ||
| 電子 | e | -1 | 0.0005 (~0) |
Example \(1})
Which is true?
- The nucleus contains protons and electrons.
- 電子の質量は原子の質量に含まれる
- 原子の場合、陽子の数=電子の数
答え
- 誤、原子核には陽子と中性子が含まれる。 電子は核の外にある。
- 誤、電子は原子の質量数に寄与しない。
- 正、すべての原子は中性で、電子と同じ数の陽子を持たなければならない。
正




