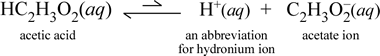CHEM 101 – 電解質
GENERAL CHEMISTRY TOPICS
電解質
水中でイオン化合物が解離して、移動性の水性イオン種が生成する。水中の溶解と解離に関する化学式。 強電解質と弱電解質.8903>
電解質(このトピックの音楽伴奏)は、水溶液中でイオン種を生成する物質です。 溶液中に電荷キャリアが存在することは、簡単な実験によって証明することができる。 水溶液の導電性は、電圧源に接続した一対の電極を水溶液中に浸して観察することができる。 溶液が流す電流は容易に測定でき、電球は溶液の導電性を示す視覚的な指標として使用できる。
この実験を純水で行うと、電球はまったく光らない。 水そのものは電気を通しにくく、非電解質である分子物質の一例である。 このことは、他の多くの分子物質にも言えることである。 例えば、砂糖(スクロース、C12H22O11)は水によく溶けるが、砂糖の水溶液は水だけよりも電気を通さないようである。 一方、塩化ナトリウムのような自由に溶けるイオン性化合物で実験をすると、電球が明るく光ります。
分子性化合物とイオン性化合物の溶解という対照的なケースで何が起こっているのかを、次のような化学式で表してみましょう。 この場合、2つの化学式の重要な違いは、後者では生成物として水性イオン種が生成されることである。 イオンは均一な混合物の中で個々に自由に拡散し、電圧をかけると電極間の電位エネルギー差に従って移動し、電流を流すことができる。 なお、これらの式の反応物側には水は表示されず、矢印の上に表示されているが、これは水が溶解過程の環境を決定していることを示している。 このシンボルにおける水の超定量性は、水を溶媒とする溶解プロセスが起きていることを読み取ることができる。 ここでは、単純な溶解過程による水溶液の生成において、水を反応物として書くことはしない。 物質が水と混ざり、水に溶けることで反応するケースは多々ある。 このような水溶液中での溶質の反応により、化学的に異なる生成物が生じる。
強・弱電解質
塩化ナトリウムのような可溶性イオン化合物が水に溶解して溶媒和イオンからなる水溶液を形成する場合、溶媒水に加えた固体塩化ナトリウムは(溶解度の限界に達していない限り)完全に解離するので化学式の右向き矢印は妥当であることが分かった。 つまり、実質的にNaCl(s)からNa+(aq)とCl-(aq)への変換は100%である。 その結果、導電性の実験では、塩化ナトリウム水溶液は豊富なイオンにより高い導電性を示し、電球は明るく光ります。 酢酸を水に溶かすと、先ほどのショ糖の場合と同じように、HC2H3O2(aq)という溶媒和していない分子種になります。 しかし、酢酸水溶液で導電性試験を行うと、塩化ナトリウム水溶液の明るさに比べて、電球は弱くても光ります。 この場合、水中で酢酸から少なくとも部分的にイオンが生成しているはずです。 この過程を表す化学式は、イオンの生成を示さなければならない。 このような方程式の妥当な提案は次のようなものです:
ここで2つのことに注意する必要があります。 第一に、これは水を反応剤として含める場合である。 水と酢酸という2つの分子物質が反応して、ヒドロニウムと酢酸という多原子イオンを生成します。 これを表す方程式がイオン方程式である。 第二の特徴は、右向きの矢印が二重の片矢印の記号に置き換わっていることで、化学平衡を意味し、この場合、反応の平衡条件は反応者に有利である。つまり、酢酸の水溶液では、酢酸の大部分が酢酸分子として残り、H+を水に渡してイオンになった割合はいつでもごく僅かであるということである。 酢酸水溶液が塩化ナトリウム水溶液ほど電気を通さず、導電率検出器の電球が弱く光るのは、このイオンの数が少ないためです。 そこで、塩化ナトリウムのような強い電解質と、弱い電解質の一例である酢酸を区別しています。
この物質は酢酸という名前が示すように、酸でもあり、弱電解質でもあります。 従って、酢酸は弱酸に分類されます。 酸の最初の(そして最も一般的でない)定義は、水中でヒドロニウムイオンを生成する物質であり、これは上記のイオン式が示すとおりですが、弱酸は比較的少量のヒドロニウムイオンを生成することを念頭に置いています。
化学者は略語が好きで、ヒドロニウムイオンの重要な略語はH+(aq)であり、これがよく使われます。 これは上の式の省略形をすぐ下に示したものです。 なお、H+自体は単なる孤立プロトン(1Hの場合)であり、水溶液中にそのような種は存在しないことも重要である。
さらに、矢印は、酢酸分子よりもはるかに少ないイオンがある反応物有利な平衡状態を示すために不等長に作られています。
ヒドロニウムをH+(aq)として表すことによって、水中の酢酸のイオン式は、上記の式で暗黙的に示されている反応物として水分子を含まずに正式にバランスされています。 弱塩基である弱電解質の例
先ほど見た酢酸は弱酸であり電解質である分子化合物である。 アンモニア(NH3)も単純な分子化合物ですが、水と少し反応してアンモニウムイオンと水酸化物イオンを生成します。 塩基の定義としては、まず、水中で水酸化物イオンを生成する物質というのが最も一般的であろう。 したがって、アンモニアは弱塩基であり、酢酸のように水溶液の塩ほど電気を通さない。 つまり、アンモニアは弱電解質でもあるのです。
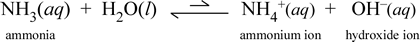
化学式の記号は、再び弱電解質の反応物有利の平衡を示します。
拡張と接続
平衡に対するより定量的なアプローチは、弱酸と弱塩基を重要な例として使用します。