CHEM 245 – 酵素阻害
BIOCHEMISTRY TOPICS
酵素阻害
阻害剤の種類と阻害可逆・不可逆の阻害剤と阻害。 競合阻害と非競合阻害のモデルと速度論的効果。 混合阻害(Mixed Inhibition)、酵素阻害の例(Examples of enzyme inhibition)。
酵素の特異性は基質によって厳密に限定されるものではない。 酵素の活性は、阻害剤と呼ばれる分子との特異的な相互作用によって低下することがよくある。 酵素の阻害は生化学において最も重要な現象の一つである。 例えば、多くの薬物、抗生物質、毒素は、酵素を阻害することによってその効果を発揮する。 基質と構造的に類似した阻害剤は、活性部位での結合を競うため、競合阻害剤となることが多い。 酵素阻害には可逆的なもの(阻害剤が非共有結合で酵素に結合する場合が多い)と不可逆的なもの(阻害剤が共有結合で酵素を修飾し、触媒作用に重要な残基を標的として作用する多くの場合がある)がある
可逆阻害の簡単なモデルをいくつか想像できる。 その中で最も単純なものは、阻害剤によって活性部位が直接閉塞されるものである。 これは基質とある程度の構造的類似性を持つ分子の場合に見られる。 この競合阻害のモデルでは、基質と阻害剤の結合は相互に排他的である。
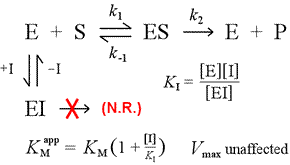
右は競合阻害の簡単な機構モデルである。 阻害剤Iは解離定数KIで遊離酵素Eにのみ結合し、基質(S)の結合を阻害する。 酵素の一部を不活性なEI複合体に固定することで、ある基質濃度において、基質と結合してESを形成し、さらに生成物に変換する可能性のある酵素が少なくなる。 1/2Vmaxに到達するために必要な量が増加し、それゆえKMの見かけの値が増加する。
基質がより大きなレベルまで増加することにより、阻害剤を圧倒し、真のVmaxにまだ近づくことができる程度まで、遊離酵素と競合させることができる。
ある重要な構造的特徴において基質に似ている分子が、活性部位での結合において基質と競合できることは容易に想像できます。 これは基質アナログと呼ばれ、酵素の競合阻害剤の一般的な例となる。 酵素が反応速度を高める方法が、反応の遷移状態を選択的に安定化させることであるならば、遷移状態に似た分子(構造と極性または電荷において)を見つけることができれば、その遷移状態アナログは非常に優れた競合阻害剤となるはずである。
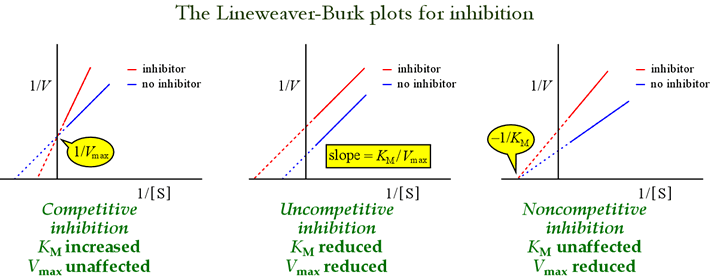
競合阻害モデルを、阻害剤が酵素-基質複合体にのみ結合する非競合阻害と対比してみます。 これは誘導結合型の酵素基質相互作用の結果として起こることが想像され、阻害剤の結合部位はESの誘導構造においてのみ利用可能である。 このモデルでは、阻害剤はES複合体のみと結合し、遊離酵素とは結合しない。 三元複合体であるESIは生成物に移行しない。 このため、見かけのVmaxが低下する効果がある。 ESIの阻害剤解離定数はKIuと表記される。 ルシャトリエの原理で説明される効果で、阻害剤の結合によりES生成「平衡」の生成物(ES)の一部が除去されるため、見かけのKMは低くなる。
阻害剤が遊離酵素と酵素-基質複合体の両方に結合する阻害のモデルを混合阻害というが、この場合、阻害剤は遊離酵素に結合し、酵素-基質複合体は基質複合体に結合する。 阻害剤の解離定数はEとESで異なる場合がある(すなわちKI≠KIu)。 KI = KIuとなる特殊なケースは非競合阻害と呼ばれる。 この場合、Vmaxは低下するが、KMは影響を受けないことに注意されたい。
可逆的酵素阻害の種類-まとめ
可逆的阻害の異なるモデルは、動力学的パラメーターへの影響によって区別できることを見てきました。 下の表は、阻害の種類とこれらのパラメーターへの影響をまとめたものである。

阻害のパターンを特定するにはLineweaver-Burkプロット、あるいはdouble-reciprocalプロットが有用である。 下図は、異なるタイプの阻害がプロットにどのような影響を及ぼすかを示しています。
酵素阻害の例
一般にアスピリンとして知られるアセチルサリチル酸塩は、鎮痛剤、解熱剤、抗炎症剤として効果的で、最も広く使用されている薬物です。 柳の樹皮の薬効は、何世紀も前から一部の文化圏で知られていた。 19世紀には、有効成分がサリチル酸アルコールと結合したものであることが判明した。 19世紀半ば、バイエル社の化学者ホフマンによって、アスピリンが開発された。
シクロオキシゲナーゼは、アラキドン酸からプロスタグランジンおよびトロンボキサンの前駆体であるプロスタグランジンG2(PGG2、構造と反応)への変換の最初のステップを触媒する。 この反応は2分子の酸素を利用し、C20:4脂肪酸をシクロペンタン環を含む過酸化物(PGG2 – PGは「プロスタグランジン」の略)へと変換させる。 また、シクロオキシゲナーゼ酵素は、PGG2をPGH2に変換するヒドロペルオキシダーゼ活性も有している。 したがって、「シクロオキシゲナーゼ」(COX)は、より正確には「プロスタグランジンエンドペルオキシドH合成酵素」(PGHS)と呼ばれることになるであろう。 アスピリンによるシクロオキシゲナーゼ活性の阻害は、酵素のセリン残基(Ser530)を化学的に修飾する能力によるものである。 このセリン残基は、アスピリンによってアセチル基を獲得し、不可逆的な修飾を受ける。 このように、アスピリンは不可逆的な阻害剤の一例である。 COXには、構成型COX-1(PGHS-1)と誘導型(炎症時)COX-2(PGHS-2)の2種類のアイソザイムが存在する。 アスピリン、イブプロフェン、ナプロキセンなどの非ステロイド性抗炎症薬(NSAIDs)は、一般に両方のアイソフォームを阻害する。 その結果、これらの薬剤は、胃腸への刺激など、好ましくない副作用を引き起こす。 したがって、薬理学的研究の現在の目標は、NSAIDsの鎮痛および抗炎症作用の大部分を媒介すると考えられているCOX-2に特異的な阻害剤を開発することである。
関連するトピックのページです。
- 化学動力学入門
- 酵素学入門
- 酵素動力学
- Michaelis-Menten equation




