Frontiers in Neuroscience
Introduction
空間ナビゲーションと記憶形成に関わる脳の領域、成人海馬における新しいニューロンの生成(Buzsaki and Moser, 2013)は、人間を含むいくつかの種で生涯を通じて持続する可塑性の顕著な形態である (Altman and Das, 1965; Eriksson et al.et.)。 1998; Moreno-Jiménez et al., 2019)。 成人の海馬の神経新生を調節する多くの条件の中で、広く説明されている最も信頼できるプロセスの1つは、既存の神経細胞集団が通常の老化で一定である一方で、神経細胞産生の年齢を介した減少です(Kuhnら、1996;Kempermannら、1998;BurkeおよびBarnes、2010)。 加齢は、シナプス伝達や可塑性を含む脳内の多くの機能に影響を与え、これらは記憶喪失に寄与すると考えられています(Burke and Barnes, 2006; Fan et al, 2017)。 海馬が加齢に伴う変化や神経変性に対して特に脆弱であることを考えると、この構造における可塑性を高める戦略を見つけることは、老化の影響を防止または軽減するために関連性が高くなります(Bartsch and Wulff, 2015)。 身体運動や認知的刺激は脳の健康を増進し、老化の影響を改善する傾向があります。 直接的な利点の1つは、中年マウスにおいてシナプス可塑性の回復、神経新生の促進、学習の改善を示す脳由来神経栄養因子(BDNF)レベルの活動依存的な増加から生じる可能性があります(Marlattら、2012;Trincheroら、2017)。 また、運動は、加齢した海馬において、ミクログリアの活性化を抑え、活動依存性のシナプス可塑性を高め、神経前駆細胞の増殖を促進し、成体生まれの顆粒細胞(GC)の発生と統合を促進します(van Praagら、2005;Kronenbergら、2006;O’Callaghanら、2009;Marlattら、2012;Gebaraら、2013)。 これらの効果は、海馬依存的な可塑性の回復に寄与し、適応的な行動と相関しています。 したがって、空間学習やパターン分離タスクのパフォーマンスが低い高齢動物は、運動後にそのパフォーマンスが向上する(van Praagら、2005;Marlattら、2012;Wuら、2015;Duzelら、2016;Xuら、2017)<5786><2580>高齢動物における運動の正の行動効果に神経発生が寄与する程度は、まだ精査中である。 身体運動によって発揮される神経新生の割合の増加が、行動改善に寄与している可能性があります。 しかし、他のメカニズムも関与している可能性がある(Meshi et al.) 運動後に老化した歯状回で新しいニューロンの統合が促進され、新しいGCの質が修正されることも、行動改善に寄与している可能性がある。 中年マウスで生まれたニューロンはゆっくりと発達しますが、持続的な自発的運動は樹状突起の成長、スパインの形成、ニューロンの統合を促進します(Trinchero et al.、2017)。 同様の効果は、環境エンリッチメント(EE)への短時間の曝露によっても観察されました(Trincheroら、2019年)。 複数のニューロンコホートにわたって蓄積されれば、運動によって引き起こされるニューロン統合の促進は、海馬依存性の学習と行動に大きな影響を及ぼすかもしれません。 本研究では、新しいGCのいくつかのコホートが、自発的なランニングを続けるマウスの既存の回路に急速に統合されること、およびマウスがランニングを停止した後もこれらの効果が持続することを実証する。”5786″
材料および方法
マウスおよび手術
C57BL/6Jオスマウスを標準条件の下でケージあたり4〜5匹で飼育した。 8ヶ月齢(8M)マウスを選択したのは、この年齢を超えると海馬の神経新生が強く低下し、標識ニューロンの研究ができなくなるからである(Morgensternら, 2008; Trincheroら, 2017)。 マウスを麻酔し(10μl生理食塩水/g中150μgケタミン/15μgキシラジン)、レトロウイルスを定位手術により滅菌校正マイクロキャピラリーを用いて右歯状回中隔領域に注入(0.15μl/分で1.5μl);ブレグマからの座標(mm単位)。 ブレグマからの座標(単位:mm):-2 前後、-1.5 外側、-1.9 腹側。 示された時間に、脳を固定し、共焦点イメージング用に切片を準備した(Trinchero et al.、2017)。 中隔歯状回からのGCのみを解析に含め、マウス脳アトラス(Paxinos and Franklin, 2001)に従い、ブレグマから-0.96〜-2.30 mmに局在する切片に対応させた。 実験プロトコルは、Fundación Instituto LeloirのInstitutional Animal Care and Use Committeeにより、Council for International Organizations for Medical Sciencesの動物を含む生物医学研究に関する原則およびGuide for the Care and Use of Laboratory Animalsに記載の規定に従って承認された
Running
無線ランニングホイールにより、各実験でランニング距離が記録された。 図1の実験では、動物は、示されたように、7日または21日間走行輪と一緒に収容された。 この状態で、マウスは1日あたり約2km走った。 図2、3では、1ヶ月、2ヶ月、3ヶ月の間、マウスは約10km/日の距離を走った。 長時間のランニングは新しいGCの形態的成熟を促進するが、短時間のランニングは促進しない。 (A)実験デザイン。 RV-GFP注入後、指示されたウィンドウで、または実験全体(0-21dpi)で1週間の自発的ランニングにさらされた。 (B)21日目のGFP(赤)発現GCの代表画像(静止群および0-21日目のランニング群)。 NeuN(青)は顆粒細胞層(GCL)を標識している(ML、分子層)。 スケールバー、50μm。 (C) 異なるグループの21dpi GFP-GCの代表的な共焦点画像。 スケールバー、50μm。 (D)異なる実行ウィンドウの樹状突起の複雑さ(長さと分岐点)。 ∗クラスカル-ワリス検定およびダンのポストホック検定後、0-21走行群と比較して、*、*、*、*はp<7742>0.05、p<7742>0.001を示す。 7日間ランニングを行った群では、いずれの群でも差は見られなかった。 サンプルサイズ(ニューロン/マウス):27/3(Sed)、14/3(0-7)、27/3(7-14)、22/3(14-21)、および15/3(0-21)。 横棒は平均±SEMを示す。 5786>
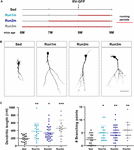
Figure 2.図2. 異なる神経細胞コホートに対するランニングの効果。 (A)実験デザイン。 RV-GFP注入後、3週間のランニングを行い、その前に鎮静状態(Run1m)、1(Run2m)、または2ヶ月のランニング(Run3m)を行った。 すべてのグループは、鎮静マウス(Sed)と比較された。 樹状突起の全長は21dpiで解析した。 (B) GFP-GCの代表的な共焦点画像。 スケールバー、50μm。 (C) 異なる走行ウィンドウの樹状突起の複雑さ(長さと分岐点)。 ∗はSedと比較してp < 0.05、p < 0.01、p < 0.001を示す(クラスカル・ワリス検定、Dunnのポストホック検定後)。 サンプルサイズ(ニューロン/マウス):20/3(Sed)、19/3(Run1m)、31/3(Run2m)、および15/3(Run3m)。 横棒は平均±SEMを示す。 5786>

Figure 3. 慢性的な運動の持続的な効果。 (A)実験デザイン。 RV-GFP注入後、3週間のランニング(Run1m)または1ヶ月の運動(Run-1m)または1ヶ月の運動と1ヶ月のランニングホイールなし(Run-2m)を先行させた。 全群を座位マウス(Sed)と比較した。 樹状突起の総長さは21dpiで解析した。 (B) 標識したGCの代表的な共焦点画像。 スケールバー、50μm。 (C) 異なる実行ウィンドウの樹状突起の複雑さ(長さと分岐点)。 ∗∗∗ クラスカル・ワリス検定およびダンのポストホック検定後、Sedと比較してp < 0.001を示す。 サンプルサイズ(ニューロン/マウス):33/4(Sed)、39/4(Run1m)、15/4(Run-1m)、および18/3(Run-2m)。 (D)CA3におけるMFB形態は、Run1mおよびRun-1m群について分析し、Sedと比較した。 代表的な共焦点画像。 スケールバー、5μm。 (E)*はKruskal-Wallis検定、*はDunnのポストホック検定後、p<7742>0.05、p<7742>0.01を表す。 サンプルサイズ:27/4(Sed)、32/4(Run1m)、18/4(Run-1m)。 横棒は平均±SEMを示す。 5786>
免疫蛍光法
免疫染色は60μm自由浮動冠状切片で行った。 抗体は3%ロバ血清と0.25%Triton X-100を含むトリス緩衝生理食塩水(TBS)中に塗布されました。 抗GFP(ウサギポリクローナル;1:500;Invitrogen)、抗NeuN(マウスモノクローナル;1:50;F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, United Statesからの贈り物)、ドンキ抗ラビットCy3およびドンキ抗マウスCy5抗体(1:250;Jackson Immuno Research Laboratories)を用いて免疫蛍光を実施した。
共焦点顕微鏡
樹状突起長測定では、35〜50枚の光学スライスを含むZスタックをとる60μm厚切片から画像を取得(40×;NA 1.3; 油浸)、エアリーユニット=1 0.8-μm 間隔(Trinchero et al, 2017). 次に、GFPを発現するGCにおいて、三次元再構成の単一平面への投影から、LSM Image Browserソフトウェアを使用して樹状突起の長さを測定した。 CA3領域のGFP標識MFBの画像を0.4-μm間隔で取得し(63×;NA1.4;油浸)、デジタルズーム6を行い、単一平面への3次元再構成の投影から糸状体の面積と個数を解析した。 以下の基準に適合する苔状繊維ブトン(MFB)を定量化のために選択した。 (i)ブトンの直径が繊維の直径の>3倍であること (ii)ブトンの少なくとも一端が苔状繊維に接続されていること (Toni et al., 2008)である。 糸状虫は大きな苔状末端(1μm<7742>長さ<7742>20μm)から発生する突起として同定した(Acsady et al.、1998)。 糸状虫の伸長は、末端あたりの突起の数を数えることによって測定した。 画像撮影および形態学的特性の解析のために、研究中のすべての実験群はオペレーターに対して盲検化した。
統計解析
特に指定しない限り、データは平均±SEMとして示される。 正規性はShapiro-Wilks検定、D’Agostino-Pearsonオムニバス検定、Kolmogorov-Smirnov検定を用いて評価し、p値は0.05とした。 データが正規性検定(ガウス分布と等分散)を満たす場合、Welchの補正を伴う対応のないt検定、またはBonferroniのポストホック検定を伴うANOVAが指示通りに使用された。 正規性を満たさない場合は、以下のようにノンパラメトリック検定を用いた。 独立比較にはマン・ホイットニー検定、多重比較にはクラスカル・ワリス検定を用いた。
結果
我々は以前、ランニングが老化した海馬における新しいGCの発達と機能統合を加速することを示した(Trinechero et al.、2017年)。 我々は今、この種の可塑性が、時間的に蓄積される持続的なレベルの活動を要求するか、またはEEへの曝露について以前に観察されたように、より短い期間のランニングがより速い統合を誘発するかどうかを調査した(Trincheroら、2019年)。 この疑問を解決するために、GFPを発現するレトロウイルス(RV-GFP)を用いて、中年マウス(8ヶ月齢;8M)において新しい神経細胞コホートを標識した。 マウスは、神経細胞発生の異なるウィンドウ内で1週間、または神経細胞成長の全期間(3週間;図1A、B)、ランニングホイールを使用することを許可された。 前述したように、座ったままのマウスでは新しいGCの発達が遅く、その結果、3週間後にはほとんど突起のない短い樹状突起が形成された。 1週間のランニングは、どの試験区間においても新生GCの一般的な外観を変化させなかった(図1C,D)。 一方、3週間のランニングでは、樹状突起の長さと分岐が増加し、神経細胞の統合が促進されたことと一致した。
観察された運動の効果は、レトロウイルスで標識した単一の神経細胞集団でテストされたものである。 しかし、新しいGCは絶えず生成されているため、運動期間内の異なる瞬間に生まれたGCも活動の影響を受けている可能性が考えられる。 この仮説を検証するために、我々は、レトロウイルス注入後3週間(簡単のために1mと呼ぶ)、常に神経細胞構造を分析するために、マウスを異なる間隔で走行輪にさらすことによって、運動開始に関して異なる時期に生まれた神経細胞コホートを標識する簡単な戦略を使用した。 こうして3つのコホートを比較した。1つは3週間走行して運動開始直後に標識したもの(Run1m)、1つは2ヶ月走行して運動開始1ヶ月後に標識したもの(Run2m)、そして1つは3ヶ月走行して運動開始2ヶ月後に標識したもの(Run3m)(図2A)であった。 このことは、自発的なランニングを行う中年マウスの脳で生まれたすべての神経細胞コホートが、急速に成長し統合されることを示している(図2B,C)。 Run3mマウスのGCの樹状突起は、Run1mやRun2mマウスの樹状突起よりもわずかに長く、神経細胞の統合の促進は、時間の経過とともに効果が蓄積するメカニズムに対応している可能性が示唆された。 5786>
次に、加齢脳における運動の効果を、活動終了後に生まれる神経細胞のコホートに対して調べた。 3-4週間のランニングが、運動開始直後(Run1m)、終了時(Run-1m)、運動終了1ヶ月後(Run-2m)に生まれた新しいGCの発達にどのような影響を与えるかを比較した(図3A)。 驚いたことに、運動開始時または運動終了時に生まれた神経細胞のコホートも同様の反応を示した(図3B,C)。 5786>
回路に完全に統合するために、GCは大きなMFBを介してCA3錐体細胞上にグルタミン酸作動性の興奮性接続を確立し、それらの端末から生じる糸状体伸長を介して錐体細胞上にGABA作動性のフィードフォワード抑制を募集する(Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015)。 共焦点解析では、Run-1mまたはRun1mで生まれた神経細胞のMFBの面積はコントロールと比較して変化が見られなかったが、フィロポディア/MFBの数は∼100%増加した(図3D,E)。 これらの結果は、身体運動が新しいGCから抑制性局所ネットワークへの接続性を特異的に増加させることを示している(Trincheroら、2019)
議論
成人の神経新生は、新しい情報処理単位の統合をもたらす複雑な発生ステップのシーケンスを含む。 顆粒下帯の神経幹細胞は静止状態を離れ、増殖する神経前駆細胞となり、前駆細胞集団を拡大する(トランジット増幅細胞)(Bonaguidi et al., 2012). 前駆細胞は神経細胞を生成し、移動、発達、回路への統合を行う。 この長い時間の間に、アポトーシス細胞死によるニューロンプールの著しい減少がある。 Voluntary exerciseとEEは、生涯を通じてネズミの成体海馬神経新生を促進する強い刺激となる(van Praag et al, 1999a, b; Kronenberg et al, 2003, 2006; Wu et al, 2008; Kannangara et al, 2011)。 老化した脳では、主に前駆細胞プールの縮小の結果として、神経新生が減少する。 ランニングとEEは、それぞれ異なるメカニズムで、加齢に伴う神経細胞産生の減少を抑制します(Kempermann et al.、2010)。 ランニングは、神経前駆細胞の増殖率を高め(van Praagら、1999b、2005;Cooperら、2018)、発達中のニューロンの成熟と機能統合を加速させる(Trincheroら、2017)という2つのレベルで作用して神経新生を促進します。 EEは生存率を高め、新しいGCの成熟も促進するが、増殖には影響しない(Trinchero et al., 2017, 2019)。
ランニングは、若齢成体マウスの発生の最初の週に新しいGCにおけるニューロン結合性の再配線と固有特性の調節も促進する(Sah et al., 2017)。 我々は最近、老化した動物におけるGCの成熟の2週間目に、EEが樹状突起の成長を誘導し、新しいニューロンの回路への統合を早める重要な時期を報告している(Trinchero et al.) 我々はここで、GCの発達のどの時期でも1週間走ることが統合に影響するかどうかを尋ねたが、影響はないことが分かった(図1)。 神経新生を制御するためには、3週間のランニング期間全体が必要であった。 短期的な調節の欠如は、顕著な変化を及ぼすために蓄積する必要のある因子が介在するメカニズムを示唆している。 興味深いことに、随意運動はBDNFの産生を悪化させ、最大作用を発揮するプラトーレベルに達する前に数週間にわたって蓄積します(Vecchioら、2018)。 ニューロトロフィンが重要なメディエーターであるにもかかわらず、ここで観察された効果は、複数のメカニズムによって媒介されていると考えるのが妥当であろう。 運動はまた、歯状回における電気活性を高め、血流を上昇させ、神経炎症を調節する(Piattiら、2011;Speismanら、2013;Trincheroら、2017)。 5786>
我々はここで、走行用車輪に慢性的に曝露された老化マウス(最大3カ月)から採取した∼3週齢のGCが、若齢成体マウスで生成された新しいGCのものと同様に、長く複雑な樹枝状配列で完全に発達した表現型を呈することを示す(図2)。 若年成体および中年マウスの成熟GCは、発生末期には、EEまたはランニングに曝露した老化マウスの3週齢GCと同等の樹状突起の長さと複雑さに達する(Piattiら、2011;Trincheroら、2017、2019)。 この蓄積された証拠は、ランニングによって誘発される成熟速度の明確な加速を物語っている
神経細胞の出力レベルでは、ランニングは糸状体伸長の急速な成長を促進したが、MBFの大きさは変更しなかった(図3D,E)。 この結果は、新しいGCは急速に統合されるが、その出力はMFBに接触した錐体細胞ではなく、CA3のGABA作動性介在ニューロン(filopodiaに接触)の活性化に偏る可能性を示唆している(Acsadyら、1998; Toniら、2008; Sunら、2013; Restivoら、2015)。 EEが、老化したマウスにおいて、MFBのサイズおよび糸状体伸長の数の両方において顕著な増加を誘発し、神経細胞出力のよりバランスのとれた調節と一致することは驚くべきことである(Trincheroら、2019)。 EEによる変化には、空間的な手がかりを符号化するために強化されるようになる特定のシナプスの活動依存的なリモデリングが含まれると推測される(Nicoll and Schmitz, 2005; Holtmaat and Svoboda, 2009)。 一方、ランニングは、新しいGCが周囲のネットワークに適切に組み立てられるまで、シナプス後部の活動を制限するメカニズムとして働くかもしれないGABA作動性介在ニューロンからの抑制トーンを維持しながら、符号化が必要になったときに特定のターゲットに接続する準備をするための一般的な刺激であるかもしれない
我々の結果は、マウスが長期間(数ヶ月)走り続けると老化脳で神経発生的シグナルが生じることを示すものだった。 この文脈では、走るマウスで生まれた後続の神経細胞のコホートが急速に発達・統合し、老化した回路に相当数の新しい神経細胞が蓄積されることになる(図4)。 若いマウスで起こるのと似た特徴を持つ新しいGCが継続的に組み込まれることで、将来の経験に反応するようにプライミングされ得るニューロンを持つ海馬が若返る。
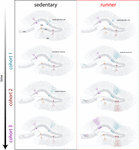
Figure 4. 中年マウスにおけるランニングによる海馬ネットワークの若返り。 自発的な運動を長時間行った後の座位マウス(左)と走行マウス(右)の神経細胞統合の時間経過を模式的に示した。 歯状回顆粒下帯では、放射状グリア様細胞(RGL)は静止状態を保っている(上)。 定住型老化マウスでは、神経新生の割合が低く、新しい神経細胞の発生が遅い(代表的なコホートを異なる色で示す)。 ランニングマウスでは、新しいGCの産生が促進され、これらの新しいユニットがより速く発達・統合し、神経ネットワークを長期にわたって累積的に拡大する。
より広い観点から見ると、現代社会に伴う長寿化は、認知機能低下の高いリスクを伴っています。 したがって、脳機能における運動のよく知られた利点の根底にあるメカニズムを理解することが重要になる。 さらに、人生の異なる間隔で運動を実践している人と、継続的に運動を実施してきた人の間には、神経変性疾患の発症リスクを低下させるという点で長期的な違いがあるかもしれません(Llorens-Martin, 2018)。 我々の結果は、継続的なランニングが多くのニューロンコホートの統合を促進し、その結果、ネットワークの複雑性を顕著に上昇させることを示しています。 海馬における新しいニューロンの統合の効力を高めるための異なる戦略を設計することは、最終的に健康および病気の老化脳で起こる認知低下を改善するための有望な可塑性のメカニズムとして役立つかもしれません。 最後に、このような神経細胞の統合と発達の加速のさまざまな側面の根底にあるメカニズムを解明することは、加齢脳における神経ネットワークの可塑性の可能性について多くのことを教えてくれるだろう。
倫理声明
動物実験は、Leloir Instituteの実験動物の使用とケアに関する委員会の審査と承認を受けた。
著者貢献
MTとMHは実験を実施しデータを分析した。 MT、MH、ASは実験をデザインし、原稿を執筆した。 ASは資金援助を行った。
資金援助
この研究は、アルゼンチン科学技術振興庁(Grant# PICT2015-3814)、国立神経疾患・脳卒中研究所、およびConsejo Nacional de Investigaciones Científicas y Técnicas (CONICET) の調査員であるASにFogarty International Center (Grant# R01NS103758) から支援された。 MTはCONICETフェローシップの支援を受けた。
Conflict of Interest Statement
著者らは、本研究が潜在的な利益相反と解釈され得るいかなる商業的または金銭的関係もない状態で行われたことを宣言する。
Acknowledgements
我々は、ASラボのメンバーが深い考察をしてくれたことに感謝する。
Acsady, L, Kamondi, A., Sik, A., Freund, T., and Buzsaki, G. (1998). ラット海馬における苔状線維の主要なシナプス後標的はGABA作動性細胞である。 J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965)(1999). ラットにおける生後海馬の神経新生のオートラジオグラフィーおよび組織学的証拠。 J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015)(Bartsch, T., and Wulff, P. (2015). 加齢と疾患における海馬:可塑性から脆弱性へ。 Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). 成体海馬における哺乳類神経幹細胞の特性に関する統一的な仮説。 Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). 加齢脳における神経可塑性。 Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). 老化したシナプスと海馬の回路ダイナミクス。 Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). 海馬-嗅覚系における記憶、ナビゲーション、シータリズム。 Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). 海馬可塑性のための逃走中。 コールドスプリングハーブ。 Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016)(2016). 老齢期の身体運動は記憶と海馬の機能を改善できるか? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al (1998). 成体ヒト海馬におけるニューロン新生。 Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017)(2017). 海馬の老化のメカニズムと若返りの可能性. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J. , and Toni, N. (2013). 成人海馬の神経新生は、自発的なランニングと加齢の条件下で、ミクログリアと逆相関する。 Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., and Svoboda, K. (2009).海馬のニューロン新生は、自発的なランニングと加齢の条件下でミクログリアと逆相関する。 哺乳類脳における経験依存的な構造的シナプス可塑性。 Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R.、他 (2011)(2011 ). ランニングはストレスを軽減し、老化したマウスの細胞発生を促進する。 Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A.他 (2010)。 なぜ、そしてどのように身体活動が経験誘発性脳可塑性を促進するのか。 Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). 老化歯状回における経験誘発性神経新生。 J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006)(2010). 運動はマウス歯状回における前駆細胞活性の加齢による減少を防ぐ。 Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D. , Jessberger, S., Yamaguchi, M. , and al. (2003). 成体海馬の増殖細胞の亜集団は、生理的な神経発生刺激に対して異なる反応を示す。 J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). 成体ラットの歯状回におけるニューロン新生:加齢に伴うニューロン前駆細胞増殖の減少。 J. Neurosci. 16, 2027-2033.
PubMed Abstract|Google Scholar
Llorens-Martin, M. (2018). アルツハイマー病を打ち負かすために新しいニューロンを運動させる。 ブレイン・プラスト(Brain Plast)。 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012)(2012). 中年期を通じたランニングは、雌のC57BL/6Jマウスにおいて、記憶機能、海馬の神経新生、BDNFレベルを改善する。 Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M.R., Saxe, M., Ansorge, M.S., David, D. , Santarelli, L., et al. (2006). 海馬のニューロン新生は環境エンリッチメントの行動効果に必要ない。 Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N.,など, (2019).All. 成体海馬の神経新生は神経学的に健康な被験者では豊富であり、アルツハイマー病患者では急激に低下する。 Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., and Schinder, A. F. (2008). 加齢歯状回における新生顆粒細胞。 J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). 海馬の苔状線維シナプスにおけるシナプス可塑性。 Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009)(2010). 長期的なトレッドミル曝露は、ラット海馬における加齢に伴う神経変性変化から保護する。 Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). マウス脳の脳定位固定座標。 アムステルダム. Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). 成体海馬における神経細胞の成熟のタイミングは、局所的なネットワーク活動によって調節される。 J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | Cross Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). 海馬における興奮性細胞集団および抑制性細胞集団との成体発生細胞結合性の発達。 J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | Cross Ref Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C. and van Praag, H. (2017)(2019. ランニングは生後1週間の成体生まれの海馬ニューロンの回路を再組織化する。 Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). 毎日の運動は、老化したラットの記憶を改善し、海馬の神経新生を刺激し、免疫および神経免疫サイトカインを調節する。 Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H.、他 (2013).。 成体で生まれた無傷の神経細胞をシリアルエンドブロックイメージングでシームレスに再構成すると、成体海馬における複雑な軸索誘導と発達が明らかになった。 J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | Cross Ref Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C.E., Gage, F. H.、他 (2008). 成体歯状回で生まれた神経細胞は、標的細胞との機能的シナプスを形成する。 Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C.,など (2017).All. 老化した海馬における新しい顆粒細胞の高い可塑性。 Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). 老化した海馬における成体生まれの神経細胞の経験依存的な構造可塑性。 Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). ランニングはマウスの神経新生、学習、長期増強を促進する。 Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). ランニングは成体マウスの歯状回における細胞増殖と神経新生を増加させる。 Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). 運動は老化マウスにおける学習と海馬の神経新生を促進する。 J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., and Aubert, I. (2018)(2017. 運動の神経保護効果:加齢を通して健康な脳を維持する。 Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu,C. W., Chang,Y. T., Yu,L., Chen,H. I., Jen,C. J., Wu,S. Y., et al. 運動は、中年マウスの歯状回における神経幹細胞の増殖、神経突起の伸長と神経前駆細胞の生存を促進する。 J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M.V., Luna, V.M., and Hen, R. (2015).運動をすると、中高年齢者の歯状回において、神経幹細胞の増殖と神経突起の成長、神経前駆細胞の生存が促進される。 Running rescues a fear-based contextual discrimination deficit in aged mice. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al(2017).。 ランニングによる記憶の増強は、老齢C57BL/6マウスの海馬領域CA1における細いスパインの保存と相関している。 Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




