Frontiers in Pharmacology
Introduction
オランザピンは統合失調症、双極性障害、精神病症状に対して最も広く用いられている第二世代抗精神病薬(SGAs)の1つである。 オランザピンは,精神病の主症状を改善するほか,大きな受容性を示し,すべての原因による中止を減少させ,将来の再発を予防する(Leucht et al.) 多くの無作為化臨床試験(RCT)およびメタ分析により、オランザピンは統合失調症患者において最も有効な抗精神病薬の一つであることが示唆されている(Leuchtら、2013;Huhnら、2019)<4214><2810>オランザピンの最も多い副作用は体重増加である(Allisonら、1999)。 オランザピンはSGAの中で最も体重増加を惹起する。 Comparison of Atypicals for First Episode(CAFE)試験では,オランザピン投与患者の80%が52週目に初期体重の7%以上を増加させた(McEvoy et al.,2007)。 また、Clinical Antipsychotic Trials in Intervention Effectiveness(CATIE)試験では、体重増加やそれに伴う代謝作用によるオランザピンの投与中止率が他の抗精神病薬に比べて2〜8倍高かった(Liebermanら、2005年)。 体重増加は、薬物治療のアドヒアランスの低下に関連するほか、医学的な罹患率や死亡率にも大きく関わってきます。 統合失調症患者における高い肥満率(42%)を考慮すると、オランザピンによる体重増加の潜在的リスクは慎重に評価されるべきです(Newcomer、2006年)。 いくつかの無作為化比較試験(RCT)研究から、精神疾患患者は一般集団よりも最大で30年早く死亡することが分かっています(Das-Munshiら、2017年)。 この集団の主な死因は心臓病である。 これらの患者における心臓病および早死の主な危険因子は体重増加である(Fekaduら、2015)
抗精神病薬による体重増加および代謝への悪影響のメカニズムはよく理解されていない(Correllら、2011)。 オランザピンは、食欲および食物摂取量の上昇と、代謝調節の活性低下または障害に関連している(Roerigら、2005;Hendersonら、2015)。 Fountaineらは、健康な男性において、オランザピンは、活動量または消費レベルの減少を示すことなく、食物摂取量の増加により体重を増加させたと報告している(Fountaine et al.) この観察は、思春期の男性精神分裂病入院患者の観察と一致している(Gothelf et al.) 患者は、4週間のオランザピン治療後、カロリー摂取量の増加により、有意に肥満度が上昇した(Gothelf et al.) しかし、食欲と体重増加の関連性に関する現在のエビデンスは決定的ではない(Poyurovsky et al.2007; Case et al.2010)。 Caseらは、4つの異なる試験において、初期の食欲の変化は全体的な体重変化と一貫して相関していなかったと報告している(Caseら、2010年)。 さらに、食欲が増加した正確な時期を報告し、食欲増加の時期に対する体重増加速度を比較し、食欲が増加した患者と変化しなかった患者の間の体重増加および代謝作用の差異を評価した研究はない。 そこで、薬剤未使用の初発統合失調症患者において、食欲増加とオランザピンによる体重変化およびそれに伴う代謝作用の関連性を評価した。”
Materials and Methods
参加者
この研究は2016年12月から2019年4月に中国中南大第二向陽病院精神衛生研究所で実施したものである。 参加者は、Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013) で定義された基準に従って統合失調症の評価を受けた。 抗精神病薬未使用/初回エピソード患者は、オランザピン治療後に体重が増加するようなので(Correll et al, 2011)、18-50 歳の初回エピソード統合失調症患者を本研究の対象とした。
除外基準は、(i)身体検査、臨床検査、心電図(ECG)結果の臨床的異常所見、(ii)知的障害、物質・アルコール使用障害などの障害、DSM-5基準による他の特定全身疾患の診断、などであった。 (iii) 糖尿病、脂質異常症、高血圧症などの心血管・代謝性疾患 (iv) 摂食障害の既往歴 (v) スクリーニング前1ヶ月以内または試験中の厳しい食事制限 (vi) 妊娠または授乳中。
介入
これまでの研究で、オランザピンによる体重増加の速度は、投与開始後12週間で最も速くなることが示唆されている(Correll et al, 2009). そこで,参加者はオランザピン(15~20 mg/日,午後8時投与)で12週間治療された。 オランザピンの初期用量は5 mg/dayで、その後1週目に15-20 mg/dayに調整した。
評価
ベースラインの評価は、人口統計学、徹底した病歴、身体測定(体重と身長)、食欲、身体検査、検査分析が含まれた。 食欲は毎日、昼食の30分前に、4つの標準化された質問で評価された。 空腹感、満腹感、食べ物について考えること、過食の4つの標準的な質問で評価した。 回答は0から10までの尺度で評価され、0=「全くない」、10=「非常にある」であった。 食欲の増加は、ベースラインの食欲スコアが>10%増加したものと定義された。 食欲減退は、ベースラインの食欲スコアが>10%減少したものと定義された。 統合失調症症状の重症度はPANSS(Positive and Negative Syndrome Scale)を用いて評価した。 副作用はTESS(Treatment Emergent Symptom Scale)により評価した。 各経過観察時に、PANSSを除くすべてのベースライン評価(身体検査、身体測定、食欲、TESSを含む)が繰り返された。 12週目にPANSSを再評価した。
治療前,空腹時に,靴を脱いで軽い室内着を着た状態で体重と身長を測定した。 食欲は昼食前に評価し、検査当日の評価医師の判断による。 血糖値、肝機能、腎機能などの検査項目は、ベーリンガー・マンハイム/日立714自動化学分析装置による酵素的手順で評価された。 インスリンは固相酵素結合免疫吸着法(ELISA法)で測定した。
主要評価項目は、食欲が増加した患者の割合、オランザピン投与から食欲増加までの期間であった。 副次的評価項目は、体重、BMI、空腹時血糖値、空腹時インスリン値、インスリン抵抗性指数、脂質プロファイル(トリグリセリド、コレステロール、高密度リポ蛋白(HDL-C)、低密度リポ蛋白(LDL-C))、PANSSスコアの変化とした。 BMIは中国肥満ワーキンググループの基準に従って算出した:健康体重(18.5≦BMI<5242>25kg/m2)、過体重(25≦BMI≦28kg/m2)、肥満(BMI<807>28kg/m2)。 脂質異常症は、中国の脂質異常症ガイドライン(Hu, 2017)に基づき、コレステロール≧5.18 mmol-1、トリグリセリド≧1.70 mmol-1、HDL-C < 1.04 mmol-1、LDL-C≧3.37 mmol-1と定義した。 臨床的に有意な体重増加のカットオフ値である12週間後にベースライン体重の7%以上増加した患者の割合の分析も含まれる(Kanders et al., 1991)
統計解析
統計解析にはStatistical Package for Social Sciences, version 25.0 (SPSS v25.0) が採用されました。 連続変数とカテゴリー変数は、それぞれ要約統計(平均と標準偏差)または度数とパーセンテージを用いて記述した。 体重、BMI、空腹時グルコースとインスリン、インスリン抵抗性指数、トリグリセリド、コレステロール、HDL-C、LDL-Cのベースラインから各時点までの変化のグループ間差の分析には、スチューデントのt検定とカイ二乗分析を使用した。 体重、BMI、インスリン抵抗性指数、LDL-C、食欲との関連を線形回帰分析で検討した。 P値(p)< 0.05を統計的に有意とした。
結果
合計33名の統合失調症入院患者(平均年齢23.5歳、範囲18-36歳)が研究に登録された。 女性患者の割合が高かった(63.6%,21/33人)。 すべての患者が正常なBMIの範囲にあった(平均BMI、21.3±1.7kg/m2)。 統合失調症の平均期間は11.2±3.7(範囲5〜18)ヵ月であった。 女性患者2名は食欲増進のため4週間後に脱落したが,残りの31名(93.9%)は試験を完了した(表1)。
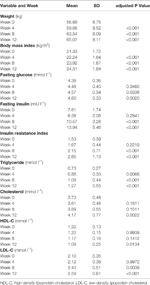
Table 1 試験別の体重および代謝測定値のまとめ。
オランザピン投与後の食欲増加
12週間のオランザピン投与後、77.4%(24/31)の患者で食欲が増加、22.6%(7/31)の患者で食欲が不変であった。 図1に示すように,食欲が増加した24名の患者において,食欲の増加はオランザピン投与開始後8週間以内に始まり,投与終了まで持続していた。 オランザピン投与開始から食欲増加までの平均期間は20.3日(SD=14.4)であり、1週間以内に25.0%(6/24)、4週間以内に70.8%(17/24)が食欲を増加させた。 また、オランザピン投与後3日目に食欲が増加した症例が2例あった。 二元配置分散分析により,オランザピンによる食欲に性別による有意差は認められなかった。
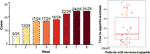
Figure 1 8週間のオランザピン治療期間中に食欲増進した患者数。
オランザピン投与後の体重及びBMIの変化
オランザピン投与後、体重及びBMIの有意な増加が認められた(表1)。 12週間のオランザピン投与期間中の平均体重増加は7.9kgであり,4週間後の1回目,2回目,3回目でそれぞれ2.4,4.0,1.5kg増加した。 女性患者の方が体重増加率が高く(P < 0.001)、試験期間中の平均体重増加は9.19kgであったのに対し、男性患者では5.90kgであった。 全患者のうち、12週間のオランザピン投与期間中に初期体重が7%以上増加した患者は80.6%(25/31)、10%以上増加した患者は61.3%(19/31)だった(補足表1)。 12週間後、51.6%(16/31)が過体重(BMI>25kg/m2)となった。
オランザピン投与後の代謝異常の変化
12週間後に空腹時血糖、空腹時インスリン、インスリン抵抗性指数、トリグリセリド、コレステロール、LDL-Cが有意に上昇し、HDL-Cが低下した(Table 1)。 本試験に組み入れられた患者のうち、ベースライン時に脂質異常症を有していた者はいなかった。
食欲増加とオランザピン誘発体重増加
オランザピン誘発体重増加に対する食欲増加の影響を検出するため、オランザピン投与12週間後の食欲増加の有無により2群(食欲増加群、食欲不変群)に分類した。
食欲不変群に比べ、食欲増加群では12週間のオランザピン投与後、体重とBMI値の有意な増加が見られた(表2)。 図2に食欲増加群と食欲不変群の体重増加量と代謝関連アウトカムの比較を示した。 詳細な解析結果は、Supplement Table 2に示した。 2群間の体重増加は、二元配置分析ANOVAを用いて有意であった(P = 0.01)。 12 週間のオランザピン治療期間中、平均体重は食欲亢進群で 9.1kg(SD=4.1) 、食欲不変群で 3.9kg(SD=2.0) 増加し、2 群間に有意差が認められた。 食欲亢進群では、食欲不変群(42.9%、χ2 = 8.27, df = 1, p = 0.004)と比較して、12週間後に初期体重の7%以上増加した患者の割合(91.7%)が大きかった。 同様に、食欲増加群(19/24、79.2%)は、食欲不変群(0.0%、χ2 = 14.32, df = 1、p < 0.001)と比較して12週間後に初期体重の10%以上増加した患者が多かった(補足表3-5)。 12週間のオランザピン投与後、食欲増加群では58.3%の患者が過体重になったのに対し、食欲不変群では28.6%の患者が過体重になった。 食欲増進はオランザピンによる体重増加を強く媒介し,媒介効果は66.2%であった。

Table 2 ベースライン,4,8,12週における食欲増進群および不変群の結果指標の記述統計学的分析。
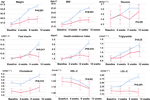
図2 食欲亢進群と不変群の体重、BMI、グルコース、脂質の比較。 青線は食欲亢進の患者、赤線は食欲不変の患者。
食欲亢進とオランザピン誘発代謝異常
12週後の食欲亢進群と不変群ではインスリン(p=0.017)、インスリン抵抗性指数(p=0.015)、LDL-C(p=0.001)に有意差が見られた(図2及び表2)。 食欲増加群では12週目にコレステロール≧5.18mmol-1が4名、トリグリセリド≧1.70mmol-1が9名、HDL-C < 1.04mmol l-1が3名、LDL-C ≧3.37mmoll -1が3名であった。 食欲亢進群では12週以降に13/24人が脂質異常症を発症したが、食欲不変群では試験期間中に脂質異常症を発症した患者はいなかった(表3)。
食欲増加月1ヵ月後に到達した体重増加のピーク
食欲増加群では、食欲増加月以前(-1M)、食欲増加月(0M)、食欲増加後1ヵ月(+1M)、食欲増加後2ヵ月(+2M)という4時点の各患者の平均体重増加を解析しました。 0Mでは-1Mと比較して体重増加の増加がみられたが、その変化は有意ではなかった(-1M vs 0M, 1.4 ± 1.2 kg vs 3.1 ± 1.4 kg)。 体重増加は+1Mでピーク成長に入り、4.3±2.0kgとなった。4kg増加した。 体重増加は+2Mで1.6±1.5kg減速した(p < 0.001)。 2Mでの体重増加は減速して安定し、-1Mと比較しても有意差は認められなかった(図3、補足表6)
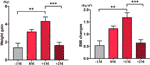
Figure 3 食欲増進群における平均体重増加速度。 試験期間中の各患者の1ヶ月あたりの平均体重増加量を、食欲増加時期月以前(-1M)、食欲増加時期月(0M)、食欲増加時期月1ヶ月後(+1M)、食欲増加時期月2ヶ月後(+2M)の4時点で分析したものである。 **はP < 0.01、**はP < 0.001を示す。
Earlier Increased Appetite Predicts More Weight Gain in 1 Month after the Month of Appetite Increase
さらに4週間以内に食欲が増加した被験者(A)と4~8週間以内に食欲が増加した被験者(B)の体重増加速度も比較検討した。 0Mでは、4週間以内に食欲が増加した被験者と4週間から8週間の間に食欲が増加した被験者の体重増加速度に有意な差はなかった。 しかし、食欲が早期に増加した参加者は、+1Mで体重増加速度が有意に増加した。 これらの結果は、食欲増進が早ければ早いほど、追跡期間中の体重増加がより多くなる可能性を示している(図4)。 BMIの変化も4つの時点で同様に観察された(図3、4)。
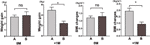
Figure 4 異なる月での食欲増加者の体重増加速度の比較。 4週間以内に食欲が増加した参加者(A)と4週間から8週間の間に食欲が増加した参加者(B)の体重増加速度を食欲増加までの月(0M)と食欲増加までの月の1ヶ月後(+1M)で比較した。 ns、は有意ではない、*はP < 0.05を示している。
食欲と代謝異常の変化速度
体重、BMI、空腹時血糖、インスリン、インスリン抵抗性指数、トリグリセリド、コレステロール、HDL-C、LDL-Cの変化の詳細記述データは表2にまとめた。 食欲増加と糖・脂質代謝の関連性を調べるために、食欲増進群の4時点のこれらの指標の変化について解析した。 グルコース、トリグリセリド、HDL-C、LDL-Cについては、どの時点でも有意な速度変化は観察されなかった。 インスリンとインスリン抵抗性指標については、+2Mの時点でのみ有意な速度増加が観察された(補足図1、補足表6)。 さらに比較すると、4週間以内に食欲が増加した参加者は、4週間から8週間の間に食欲が増加した参加者と比較して、0Mと+1Mではインスリンとインスリン抵抗性指数の速度が有意に増加しないことが示唆された(補足図2)
オランザピン誘発体重増加と代謝異常に対する食欲の予測
体重増加、血糖、脂質の値に食欲増加がどのように作用するかを線形回帰分析により評価した。 性別、年齢、身長、期間などの統計的に有意な変数をコントロールした後、体重増加、BMI、空腹時グルコース、インスリン、インスリン抵抗性指数、トリグリセリド、コレステロール、HDL-C、LDL-Cを従属変数、食欲を独立変数として回帰分析に用いた。 食欲の増加は、体重(β = 0.67, p = 0.0003), BMI(β = 0.63, p = 0.0004), インスリン(β = 0.49, p = 0.019), インスリン抵抗指数(β = 0.51, p = 0.0149), LDL-C(β = 0.0149)の変化と関連していた。61, p = 0.0035)(補足表7)。
オランザピン投与後、臨床症状(PANSSで評価、p < 0.001)のベースラインからエンドポイントへの有意な改善が認められた。 食欲増加群と食欲不変群ではPANSSに有意差は認められなかった(p<807> 0.05)。
副作用
試験を終了した全31例中、9例(29.0%)、傾眠が8例(25.8%)、肝機能異常が4例(12.9%)、アカシジアが2例(6.5%)、便秘が4例(12.9%)、1例(3.0%)が報告されています。また、80.6%(25/31)の患者が試験期間中に体重を7%以上増加させた。
考察
今回の前向き研究では、オランザピン投与後に食欲が増加した患者が77.4%おり、これらの食欲増加した患者は食欲不変の患者よりも体重増加した(9.1 kg vs 3.9 kg)ことが主な結果であることが示された。 同様に、食欲増加群では、初期体重を7%または10%以上増加させた患者が多く、オランザピンによる治療を受けた薬剤未使用の初発統合失調症患者において、食欲増加は実質的な体重増加に関連することが示唆された。 さらに、線形回帰分析によっても、食欲増進はオランザピンによる体重増加と強く関連していることが支持された。 これらの知見は、これまでの報告(Gothelf et al.、2002;Cope et al.、2005)と同様であった。 村下ら(2005)は、オランザピン治療を受けた精神分裂病患者において、食欲を刺激するグレリン値の上昇と体脂肪率の上昇を観察した。 無作為化二重盲検試験の結果、オランザピンはクロザピンよりも食欲およびむちゃ食いをより強く誘発することが示唆された(Murashita et al.) 同様の結果は、オランザピンで治療したマウスでも報告されている(Copeら、2005年)。 また、オランザピンの複数の受容体部位、特に食欲を調節するD2及び5H3受容体への作用は、神経性食欲不振症や化学療法による悪心・嘔吐の治療に応用されている(Klugeら、2007;Tanら、2009;Kafantarisら、2011)<4214><2810>また、オランザピン初期投与から4週間で増加した患者数は、平均20.3日、70.8%に上ることが分かった。 中にはオランザピン投与後3日目という早い段階で食欲が増加した患者もいた。 興味深いことに、食欲が早期に増加した患者は、食欲が早期に増加した患者よりも体重が増加しやすく、体重増加のピークは食欲増加発生から1ヵ月後であった。 オランザピンによる食欲には男女差は認められなかったが、女性患者の方が体重が増加しやすかった(P < 0.001)。 したがって,食欲は,特に女性患者において,オランザピン誘発性体重増加を予測する指標として考慮する必要がある。 臨床現場では,医師はオランザピン投与後早期に食欲が増加する患者に注意を払い,体重増加防止策を開始すべきである。
オランザピン投与患者は初期体重の7%以上の増加を示し,これは過去の知見(Gothelfら,2002;Wuら,2008)と一致する。 有意な体重増加に加えて、オランザピン投与患者は12週間後にグルコースおよび脂質の代謝が著しく撹乱されたが、これは以前に発表された統合失調症患者における観察と一致している(Correll et al.) 食欲不変群の患者と比較して、食欲亢進群では有意な脂質の異常が認められた。 空腹時血糖値は2群間で有意な差はなかった。 早期に食欲が増加した参加者は、食欲増加後の数カ月間、インスリンの速度およびインスリン抵抗性指数の増加を示さなかった。 食欲がグルコース値に影響を与えなかったことから,グルコース値は体重増加とは無関係である可能性がある。
体重増加,代謝障害,関連する病的状態など,抗精神病薬に関連する身体的健康有害結果は,長年認識されてきた(Wuら,2016)。 先行研究では,食欲がオランザピンによる体重増加や代謝性有害作用を予測する可能性が示唆されている(Gothelfら,2002;Poyurovskyら,2007;Fountaineら,2010)。 我々の知る限り、本研究は未治療の初回エピソード統合失調症患者におけるオランザピン投与後の食欲、体重増加、代謝異常の関連を評価した最初の研究である。 本研究で得られた知見は,臨床における合理的な薬物療法の選択や,オランザピンによる体重増加や代謝異常の予防について,より多くの示唆を与えてくれるものである。 まず,本研究では,対象患者全員に同じ標準化された食事メニューが提供されたものの,食事や間食などの食物摂取量を測定していない。 高脂肪と果糖の摂取は,中枢性食欲調節に影響を与えることで食欲コントロールを低下させる可能性がある。 実際、高フルクトース食は中枢の食欲シグナル伝達と認知機能に悪影響を及ぼす(Lowetteら、2015;Dalviら、2017)。 次に、研究期間中のレプチンおよびグレリンレベルは調べていません。 脂肪組織と胃からそれぞれ分泌されるレプチンとグレリンは、食物摂取とエネルギー代謝の調節に重要な役割を果たします(Cuiら、2017年)。 いくつかの研究では、オランザピン治療開始後の最初の数週間で、レプチンレベルの上昇とグレリンレベルの低下が見られた(Basoglu et al.、2010;Stip et al.、2012;Lu et al.、2015)。 レプチン値の増加は数週間安定するが、グレリン値はより長期に渡って増加する(Sentissi et al.、2008)。 今後の研究では,食欲増加に対するレプチンやグレリンの反応,代謝パラメーターや臨床効果との関係などをモニターする必要がある。 さらに、我々は研究期間中の活動レベルをモニターしていない。 オランザピンは食欲と食物摂取量の増加のみによって体重を増加させ、安静時エネルギー消費量には有意な差がなかったと報告した研究もあるが(Gothelf et al.、2002;Fountaine et al.) オランザピン投薬による身体活動の低下が報告された研究も多数ある(Perez-Cruzado et al.,2018)。 本研究では、12週間のオランザピン治療期間中に、29.0%の患者が活動低下を、25.8%の患者が傾眠を報告しました。 Hillebrandら(2005)は、オランザピン治療が活動性食欲不振にさらされたラットの身体的な身体活動を減少させることを発見しました。 また、オランザピン治療は神経性食欲不振症患者の活動量を減少させたが、未治療の患者と比較して体重や血漿レプチン値に有意な差は認められなかった。 我々の以前の研究では、心理教育、食事、運動プログラムを含むライフスタイルへの介入が、抗精神病薬による体重増加を減少させることができることが示された(Wu et al.) さらに、オランザピンによる食欲増進と代謝の変化がその薬理作用に特異的に関連していると解釈できるように、より多くの患者を同年齢の健常対照者と比較することが望ましいと思われる。 さらなる研究は、オランザピン治療後の食欲増加のメカニズムに焦点を当てるべきである(Koopmannら、2012年;Sweeneyら、2017年;Mancusoら、2019年)。 線条体領域の報酬系は、抗精神病薬に関連した体重増加と関連している可能性があります(Nielsenら、2016)。 また、オランザピン投与後の食欲増加の背景には、前帯状皮質下部の活動の変化が一部存在する可能性がある(Pawlowski et al.、2018)。 食欲に関連する深部脳活動のオランザピンモジュレーションを調べるために、画像研究を行うべきである。
結論
結論として、我々の研究は、薬剤未使用の統合失調症初発患者のオランザピン誘発体重増加および脂質異常症に食欲が関連していることを示した。 食欲の変化を評価することは,体重増加予測のための簡単で実用的な方法であり,臨床医に介入戦略のための時間と選択肢を提供するものである。 食欲を減退させ、食事摂取量を減らすことを目的とした早期の食事の工夫は、オランザピン治療を受ける統合失調症患者の体重管理に有用である。
Data Availability Statement
この研究のために作成したデータセットは、対応する著者に依頼すれば入手可能である。
Ethics Statement
本研究はヘルシンキ宣言(G.A.o.t.W.M. Association, 2013)に従って実施し、中南大学第二向陽病院倫理委員会によって承認された。 参加者に研究の完全な説明を行った後、研究参加前にインフォームドコンセントを得た。
Author Contributions
JHは患者データの分析と解釈を行い、原稿執筆に大きく貢献した。 G-RHは主に研究の設計と実行を行った。 YeY、C-CL、J-MX、Y-JL、X-JPは、患者の募集、データの質の監視、治療中に発生した有害事象の記録に協力した。 YiYは原稿の修正に協力した。 J-PZは研究設計を指導した。 RR-Wは内容全般の責任者であった。 4214>
Funding
本研究は、中国国家科学基金(助成番号2016YFC1306900)および中国国家自然科学基金(助成番号81622018)の重要R&Dプログラムプロジェクトにより支援されたものである。 およびNo.81901401)。
Conflict of Interest
著者らは、研究が潜在的な利益相反と解釈できるいかなる商業または金銭的関係もない状態で行われたことを宣言する。
Acknowledgements
我々は、参加者の貴重な貢献と開業医のサポートに感謝したい。 また、論文の質を高めるために貴重なコメントと示唆をいただいた複数の匿名査読者に感謝したい。
補足資料
この論文の補足資料は、オンラインで見ることができる。 https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
補足 図1|食欲増進群における血糖値および脂質の変化速度。 試験期間中の1ヶ月ごとの各患者の平均変化値を、食欲増進時期月以前(-1M)、食欲増進時期月(0M)、食欲増進時期月1ヶ月後(+1M)、食欲増進時期月2ヶ月後(+2M)の4時点に分析した。
補足図2|異なる月での食欲増進対象者のインシュリンとインシュリン耐性指数変化の速度の比較。 4週間以内に食欲が増加した参加者(A)と4~8週間の間に食欲が増加した参加者(B)の食欲増加までの時間(0M)と食欲増加までの時間(+1M)の1ヵ月後の速度を比較しました。
補足表1|食欲が増加した患者において、4、8、12週目に初期体重が7%以上または10%以上増加した患者数|
補足表2|4、8、12週目に初期体重が7%以上または10%以上増加した患者数。
補足表3|食欲不変の患者において、4、8、12週目に初期体重が7%または10%以上増加した患者数|
補足表4|4、8、12週目に食欲増加患者と食欲不変の患者で7%、10%の体重増加を示した数の比較|
補足表4|食欲増加患者、食欲不変の患者で初期体重が7%、10%増加した数の比較。
補足表5|食欲増加群の平均体重増加、グルコース、脂質の変化の速度を、食欲増加時期月以前(-1M)、食欲増加時期月(0M)、食欲増加時期月1ヶ月後(+1M)、食欲増加時期月2ヶ月後(+2M)の4時点で解析した結果。 nsは有意でない、*はp値< 0.05、**はp値< 0.01、**はp値< 0.001を示す
補足 表6|年齢、罹病期間、性別を制御しながら一般線形混合モデルから体重増加および代謝関連転帰尺度に対する食欲効果の推定を行う。
補足表7-1|治療期間中の体重、BMI、インスリン、IRI、LDL-Cの患者ごとの変化(群別)
補足表7-2|体重増加および代謝関連アウトカム指標に対する食欲の影響の推定値
補足表7-2|体重増加、代謝関連アウトカム指標に対する食欲の影響の推定値。
略語
SGAs,第2世代抗精神病薬,RCT,無作為化臨床試験,CAFÉ,The Comparison of Atypicals for First Episode,CATIE,The Clinical Antipsychotic Trials in Intervention Effectiveness,DSM-5, 精神疾患の診断と統計マニュアル-第5版,など。 心電図、PANSS、陽性・陰性症状評価尺度、TESS、緊急症状評価尺度、ELISA、酵素結合免疫吸着測定法、BMI、肥満度、HDL-C、高密度リポ蛋白、LDL-C、低密度リポ蛋白。
Allison,D. Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al.(1999年)。 抗精神病薬による体重増加:包括的な研究統合。 Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U.B…, 初発男性精神病患者における6週間のオランザピン治療中のグレリン、コレシストキニン、ビスファチン、レプチン、アグーチ関連タンパク質のレベル。 Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J. , Hoffmann, V. P. (2010). オランザピンによる治療中の体重変化の予測における食欲の潜在的役割。 BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D. , Allison, D. (2005). 抗精神病薬による体重増加:動物モデルの開発。 Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A.K. (2009).精神科医による抗精神病薬の投与は、体重増加の原因となる。 小児および青年における第二世代抗精神病薬の初回使用時の心代謝系リスク。 Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011).抗精神病薬の使用は、心筋梗塞や脳梗塞を引き起こす可能性がある。 抗精神病薬と肥満。 Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K.(2017年). 肥満におけるレプチンおよびグレリン抵抗性の細胞および分子基盤. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P.S., Chalmers, J.A., Luo, V., Han, D.Y., Wellhauser, L., Liu, Y., et al. (2017). 高脂肪は視床下部において急性および慢性炎症を誘発する:食欲を調節するNPYニューロンに対する高脂肪食、パルミチン酸およびTNF-αの影響。 Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al(2017).の項を参照。 重症精神疾患におけるエスニシティと過剰死亡率:コホート研究。 Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al(2015).精神科の病気と過剰死亡率…. 重症精神疾患における過剰死亡率:エチオピア農村部における10年間の人口ベースコホート研究。 Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R.ら(2010年). 健康な男性へのオランザピン投与に伴う食事摂取量およびエネルギー消費量の増加。 Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). 世界医師会ヘルシンキ宣言:人間を対象とする医学研究のための倫理原則。 JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L.,et al. (2002). オランザピンで治療中の男性青年期統合失調症入院患者における食事摂取量の増加と習慣的活動レベルの低下に関連した体重増加。 Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). 統合失調症および他の重症精神疾患患者における心代謝リスク上昇の病態生理学的メカニズム。 Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapineは活動性食欲不振に曝されたラットの身体活動を低下させる:神経性食欲不振症の治療への示唆の可能性? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). 中国における脂質異常症と動脈硬化性心血管病の予防と治療のための新しいガイドラインとエビデンス。 Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al.(2019).の項参照。 成人のマルチエピソード統合失調症の急性期治療における32種類の経口抗精神病薬の有効性と忍容性の比較:系統的レビューとネットワークメタ解析。 Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M.ら (2011). 神経性食欲不振の青年に対するオランザピン併用療法のプラセボ対照パイロット試験。 J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). 肥満のメソッド。 Conn “s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M.,et al. (2007). Clozapine と Olanzapine は食物渇望とむちゃ食いに関連している:無作為化二重盲検試験の結果。 J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K.、et al. アルコール依存症の早期禁酒者における食欲ペプチドアセチル化グレリンとアルコール渇望の関連性。 Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C. , Arbter, D. , Engel, R. R. , Li, C. , Davis, J.M. (2009).アルコール依存症患者において、食欲ペプチドであるアセチル化グレリンとアルコール渇望との関連性。 統合失調症に対する第二世代抗精神病薬と第一世代抗精神病薬の比較:メタアナリシス。 Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F.、他 (2013). 統合失調症における15種類の抗精神病薬の有効性と忍容性の比較:複数治療法のメタアナリシス。 Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O.他 (2005).The Last-Definition of the Year and the Year. 慢性統合失調症患者における抗精神病薬の有効性。 New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P.(2015)…(英文)。 高フルクトース食の中枢性食欲シグナルと認知機能への影響。 Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M.L., Wang, T.N., Lin, T.Y., Shao, W.C., Chang, S.H., Chou, J.Y., et al. (2015). アディポサイトカインと総グレリンの血漿レベルに対するオランザピンとクロザピンの差異効果。 Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al(2019).の項参照。 食物摂取後の食欲調節ホルモンの変化は、拒食症神経症の少女および若い女性における報告された食欲およびヘドニック摂食の測定値の変化と関連している。 Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M. , Gu, H., Lazarus, A. , etc. (2007). オランザピン、クエチアピン、リスペリドンの初期精神病の治療における有効性と忍容性:無作為化二重盲検法による52週間の比較。 Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I. , Inoue, T. , Takahashi, Y. , Hosoda, H. , Kangawa, K. , et al. オランザピンは統合失調症患者において血漿グレリン濃度を増加させる。 Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J.W. (2006). 双極性障害と統合失調症患者における医療リスク。 J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). 初期治療中の統合失調症患者における線条体報酬活動と抗精神病薬に関連した体重変化。 JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. 睡眠中のsLORETAによるOlanzapine後の食欲亢進のメカニズムの検討. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018).ペレス-クルスアド, D., クエスタ-バルガス, A., ベラ-ガルシア, E., マヨラル-クレリーズ, F. (2018). 重症精神疾患における薬物療法と身体活動・体力。 Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R.ほか (2007).PubMed. オランザピン治療統合失調症患者における食欲および体重増加に対するレボキセチンの減弱効果:二重盲検プラセボ対照試験。 Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D. , Gosnell, B. A. , Steffen, K.J. , et al. オランザピンとリスペリドンの食行動に対する効果のプラセボとの比較。 J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O.Epelbaum, J.Olie, J.P.Poirier, M.F. (2008). 異なる抗精神病薬治療中の統合失調症患者におけるレプチンとグレリンのレベル:レビュー。 Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B.、他 (2012). 統合失調症患者におけるオランザピン16週間投与後の食欲情報処理に関連する神経変化。 Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). 内側中隔グルタミン酸ニューロンの食欲抑制的役割。 Proc. Natl.Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H.、他 (2009). 化学療法による悪心・嘔吐の予防を目的としたOlanzapineの臨床研究。 J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. このような場合、「抗精神病薬による体重増加の治療における生活習慣への介入とメトホルミン:無作為化比較試験」(以下、「本試験」という。 Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H.他 (2016).生活習慣病予防のための生活習慣介入とメトホルミン。 抗精神病薬による脂質異常症のメトホルミン治療:2つの無作為化プラセボ対照試験の解析。 モル. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




