Natriumchloride, NaCl
Het klassieke geval van ionische binding: de natriumchloridemolecule wordt gevormd door de ionisatie van natrium- en chlooratomen en de aantrekkingskracht van de resulterende ionen.
Een natriumatoom heeft één 3s elektron buiten een gesloten schil, en er is slechts 5,14 elektronvolt energie nodig om dat elektron te verwijderen. Het chloor mist één elektron om een schil te vullen, en geeft 3,62 eV vrij wanneer het dat elektron verwerft (zijn elektronenaffiniteit is 3,62 eV). Dit betekent dat het slechts 1,52 eV energie kost om één van de natriumelektronen aan het chloor af te staan wanneer ze ver van elkaar verwijderd zijn. Wanneer de resulterende ionen dichter bij elkaar worden gebracht, wordt hun elektrische potentiële energie steeds negatiever en bereikt -1,52 eV bij ongeveer 0,94 nm afstand. Dit betekent dat als neutrale natrium- en chlooratomen zich dichter dan 0,94 nm van elkaar bevinden, het energetisch gunstig zou zijn om een elektron van Na naar Cl over te brengen en de ionische binding te vormen.
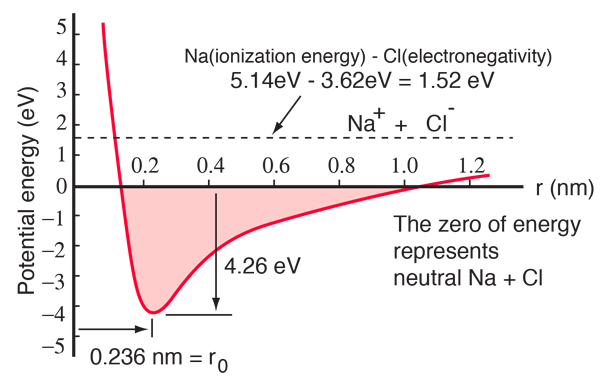
De potentiaalenergiekromme laat zien dat er een minimum is bij een afstand van 0,236 nm en dan een steile stijging van de potentiaal die een afstotende kracht vertegenwoordigt. Deze afstotende kracht is meer dan alleen een elektrostatische afstoting tussen de elektronenwolken van de twee atomen. Zij heeft een kwantummechanisch karakter dat zijn oorsprong vindt in het uitsluitingsprincipe van Pauli, en wordt dikwijls gewoon de “uitsluitingsprincipe-afstoting” genoemd. Wanneer de ionen ver van elkaar verwijderd zijn, overlappen de golffuncties van hun kernelektronen elkaar niet noemenswaardig en kunnen zij identieke quantumgetallen hebben. Naarmate zij dichter bij elkaar komen, leidt de toenemende overlapping van de golffuncties ertoe dat sommige in hogere energietoestanden worden gedwongen. Geen twee elektronen kunnen dezelfde toestand innemen, dus als een nieuwe reeks energietoestanden wordt gevormd voor het samengestelde tweekernsysteem, worden de lagere energietoestanden gevuld en worden sommige elektronen in hogere toestanden geduwd. Dit kost energie en wordt ervaren als een afstoting, waardoor de ionen niet dichter bij elkaar kunnen komen.
Het potentiaaldiagram hierboven is voor gasvormig NaCl, en de omgeving is anders in de normale vaste toestand waar natriumchloride (keukenzout) kubusvormige kristallen vormt. De ionenscheiding is 0,28 nm, iets groter dan die in de gasvormige toestand.
Een belangrijk onderdeel van de studie van de moleculaire structuur is de beschrijving van de chemische bindingen die tussen atomen worden gevormd. De klassieke studies zijn de uitersten van de ionische binding in natriumchloride en de covalente binding in het waterstofmolecuul.
| Chemische bindingen | Pauli afstoting in ionische bindingen |
Bondsenergie voorbeeld




