3.3: Subatomic Particles – Electrons, Protons, and Neutrons
Identifying and Locating the Subatomic Particles
W 1897 roku, brytyjski fizyk J. J. Thomson (1856-1940) udowodnił, że atomy nie były najbardziej podstawową formą materii. Jego eksperymenty polegały na wykorzystaniu kineskopów (CRT). W warunkach próżni urządzenia te wytwarzają niewidzialne promienie, które pochodzą z elektrody ujemnej (katody) i biegną dalej do elektrody dodatniej (anody). W tych eksperymentach Thomson wykazał, że promienie katodowe mogą być odchylane lub zginane przez pola magnetyczne lub elektryczne, co wskazywało, że promienie katodowe składają się z naładowanych cząstek. Co ważniejsze, mierząc stopień odchylenia promieni katodowych w polach magnetycznych i elektrycznych o różnym natężeniu, Thomson był w stanie obliczyć stosunek masy do ładunku cząstek. Ponieważ ładunki podobne odpychają się, a przeciwne przyciągają, Thomson doszedł do wniosku, że cząstki mają ładunek ujemny netto; cząstki te nazywamy teraz elektronami. Co najbardziej istotne dla dziedziny chemii, Thomson odkrył, że stosunek masy do ładunku w promieniach katodowych jest niezależny od natury metalowych elektrod lub gazu, co sugerowało, że elektrony są podstawowymi składnikami wszystkich atomów.
W latach 1910-tych eksperymenty z promieniami X doprowadziły do następującego pożytecznego wniosku: wielkość ładunku dodatniego w jądrze każdego atomu danego pierwiastka jest taka sama. Innymi słowy, wszystkie atomy tego samego pierwiastka mają taką samą liczbę protonów. Co więcej, różne pierwiastki mają różną liczbę protonów w swoich jądrach, a więc liczba protonów w jądrze atomu jest charakterystyczna dla danego pierwiastka. Odkrycie to było tak ważne dla naszego zrozumienia atomów, że liczba protonów w jądrze atomu nazywana jest liczbą atomową. Eksperymenty te zostały przeprowadzone przez Ernesta Rutherforda. Przypisuje mu się zasługę zdefiniowania centralnego miejsca w atomie, które obecnie nazwano jądrem.
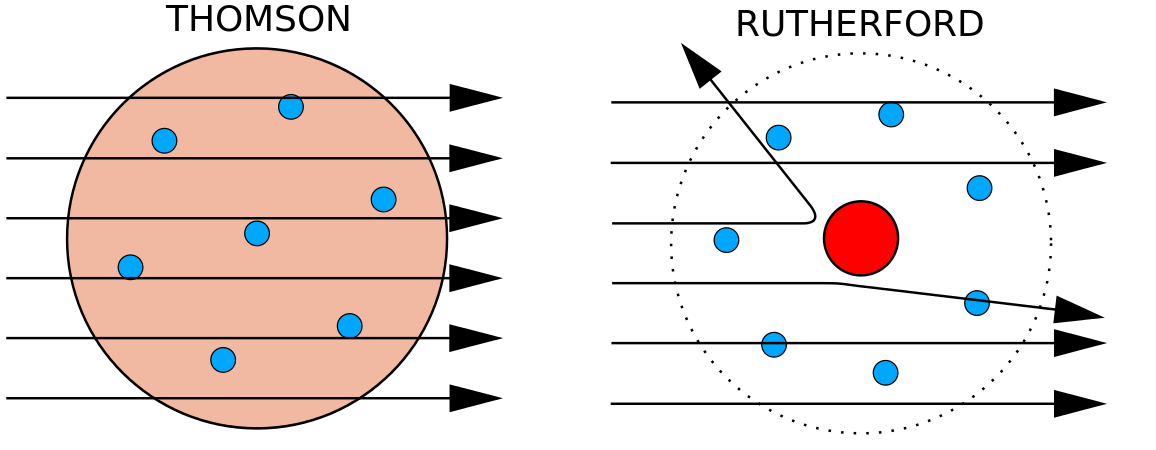
Rutherford był świadomy, że protony znajdowały się wewnątrz tego regionu. Jeden z kolegów Ernesta Rutherforda, James Chadwick, przeprowadzał i badał reakcje radioaktywne berylu. Po uderzeniu w jądro berylu cząstkami alfa, emitowana była cząstka neutronu. W 1932 r. James Chadwick ogłosił istnienie trzeciej cząstki subatomowej – neutronu. Cząstka ta ma masę 1 atomowej jednostki masy, ale nie posiada żadnego ładunku. Po tym odkryciu natychmiast rozpoczęto naukę i technikę jądrową.
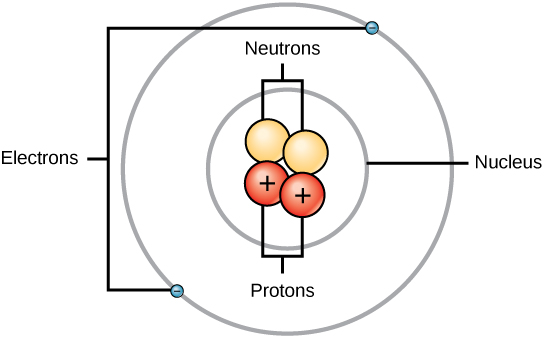
Masy trzech cząstek subatomowych mogą być wyrażone w amu (atomowych jednostkach masy) lub gramach. Dla uproszczenia będziemy posługiwać się jednostką amu dla trzech subatomów. Zarówno neutronom jak i protonom przypisuje się masy po 1 amu. Z kolei elektron ma znikomą masę 0,0005 amu. Masa tego subatomowego cząsteczki nie jest reprezentowana w masie dziesiętnej, która jest wyświetlana na układzie okresowym. Tylko protony i neutrony przyczyniają się do wartości masy atomu.
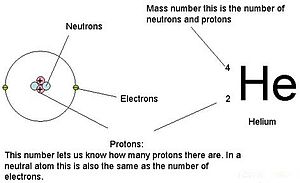
pl:User:Materialscientist)
Dla atomów (gatunków neutralnych) liczba elektronów jest równa liczbie protonów. W związku z tym wszystkie atomy mają ładunek całkowity równy zero. Dyskusja na temat jonów (atomów, które zyskują lub tracą elektrony) znajduje się w drugiej części tego rozdziału. Atomy, które różnią się wartościami neutronów i masy od podanych w tabeli, nazywamy izotopami. Te szczególne gatunki można zobaczyć w następnej części tekstu.
| Cząstka subatomowa | Symbol | Ładunek względny | Lokalizacja | Masa Amu |
|---|---|---|---|---|
| Proton | p | +1 | wewnątrz jądra | 1 |
| Neutron | n | 0 | wewnątrz jądra | 1 |
| Elektron | e-. | -1 | poza jądrem | 0.0005 (~0) |
Przykład
Który z nich jest prawdziwy?
- Jądro zawiera protony i elektrony.
- Masa elektronu jest zawarta w masie atomu
- Dla atomu liczba protonów = liczba elektronów.
Rozwiązanie
- Fałszywe, jądro zawiera protony i neutrony. Elektrony znajdują się poza jądrem.
- Prawda, elektrony nie przyczyniają się do liczby masowej atomu.
- Prawda, wszystkie atomy są obojętne i muszą mieć taką samą liczbę protonów jak elektronów.
.




