Benign Neoplasms of the Vulva | GLOWM
Condyloma Acuminatum
Infekcje sromu wirusem brodawczaka ludzkiego (HPV) są częstym zjawiskiem klinicznym. Zakażenia HPV są klasyfikowane jako kliniczne lub subkliniczne, w zależności od zakaźności wirusa i odpowiedzi dotkniętego nabłonka. Typowym objawem jest miękka, różowo-biała, brodawkowata zmiana nabłonkowa. Zmiany te mogą występować pojedynczo lub w skupiskach, które mogą się zrastać (ryc. 1). Typowe lokalizacje na sromie to napletek, przedsionek i krocze. Często obserwuje się również lokalizacje okołoodbytnicze i analne.
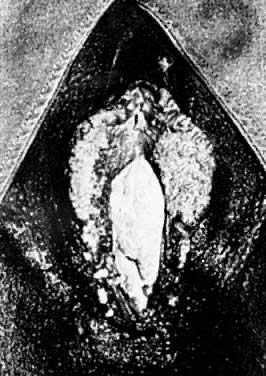 Ryc. 1. Liczne kłykciny kończyste sromu.
Ryc. 1. Liczne kłykciny kończyste sromu.
Pomimo że istnieje ponad 60 podtypów HPV, stosunkowo niewiele z nich dotyczy sromu.1 Podtypy HPV, które najczęściej występują na sromie to HPV 6 i HPV 11. HPV 2, wirus związany z powszechnymi brodawkami nabłonkowymi, jest również obserwowany w nabłonku płaskim sromu.2 Podtypy HPV, które są związane z większą częstością transformacji złośliwej na szyjce macicy, a mianowicie HPV 16, 18, 31 i 35, mogą być obecne w zmianach na sromie.1 Częstość rozpoznawania zmian HPV w sromie, pochwie i szyjce macicy znacznie wzrosła w ciągu ostatnich trzech dekad.3 Wzrost ten jest częściowo spowodowany postępem w technikach diagnostycznych, takich jak łańcuchowa reakcja polimerazy i techniki hybrydyzacji DNA. Chociaż trudno jest oszacować częstość występowania lub rozpowszechnienie zakażenia, szacowany odsetek chorych z klinicznym i subklinicznym zakażeniem HPV w niektórych populacjach uczelni wyższych przekracza 40%.1 Nie ma wiarygodnej metody identyfikacji zakażenia subklinicznego lub uśpionego. Nawet jeśli weźmie się pod uwagę tylko klinicznie wyrażone zakażenie HPV, jest ono obecnie jedną z najczęstszych chorób przenoszonych drogą płciową. Niektóre zakażenia HPV mogą ulec progresji do śródnabłonkowej neoplazji sromu (vulvar intraepithelial neoplasia, VIN), a jeszcze mniejszy odsetek może ulec dalszej progresji do inwazyjnego raka płaskonabłonkowego sromu, ale większość zmian ogranicza się do ekspresji HPV cutaneus, znanego jako brodawka weneryczna lub kłykciny kończyste. Stany immunosupresyjne i ciąża wiążą się z powiększeniem i progresją zmian kłykcin kończystych (ryc. 2).3
 Ryc. 2. Przerostowe kłykciny kończyste u ciężarnej pacjentki.
Ryc. 2. Przerostowe kłykciny kończyste u ciężarnej pacjentki.
Histologicznie kłykciny kończyste wyglądają jak brodawczaki nabłonkowe z akantozą i parakeratozą (ryc. 3). Niektóre komórki nabłonka wykazują atypowe jądra i aureole okołojądrowe, które uważa się za przejaw infekcji HPV.2 Komórki te znane są jako koilocyty. Leżący u podłoża zrąb zwykle wykazuje łagodną reakcję zapalną. Biopsje zmian kłykcin kończystych, które są oporne na leczenie lub mają nieprawidłowy wygląd, powinny być wykonane w celu histologicznego potwierdzenia rozpoznania. Można wówczas dokonać różnicowania między kłykcinami kończystymi a brodawczakiem sromu lub innymi zmianami chorobowymi sromu.
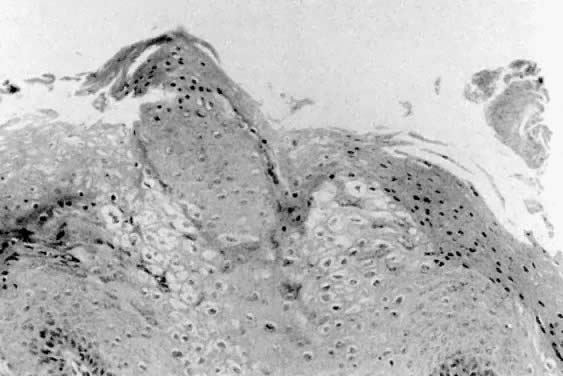 Ryc. 3. Kłykciny kończyste wykazujące akantozę, parakeratozę i zmiany koilocytotyczne.
Ryc. 3. Kłykciny kończyste wykazujące akantozę, parakeratozę i zmiany koilocytotyczne.
Leczenie polega na zniszczeniu skórnych manifestacji zakażenia HPV. Eradykacja wirusa z nabłonka nie jest klinicznie możliwa. Kontrolę ekspresji wirusa w nabłonku można osiągnąć za pomocą środków stosowanych miejscowo, takich jak kwas trójchlorooctowy, kwas dwuchlorooctowy, podofilina lub jej pochodne, lub miejscowo 5-fluorouracyl (5-FU). Krioterapia, waporyzacja laserowa oraz elektroekscytacja lub desykacja to inne metody leczenia. Śródskórne lub ogólnoustrojowe podawanie interferonu jest kolejną opcją terapeutyczną, która zwykle jest zarezerwowana dla zmian nawracających. Nawracające wirusowe zmiany skórne są zwykle leczone za pomocą alternatywnych metod leczenia lub ich kombinacji.
Rak brodawkujący sromu pojawia się jako duży kłykciny kończyste lub zmiana podejrzana o raka inwazyjnego. Zmiana ta, opisana po raz pierwszy przez Buschke i Lowensteina jako kłykcina olbrzymia,2 jest związana z podtypem wirusa HPV 6.1 Rak brodawkowaty może obejmować duże powierzchnie sromu i ma raczej granicę pchającą niż naciekającą. Charakterystyczna jest jego lokalizacja w obrębie sromu. Najlepszym sposobem leczenia jest szerokie wycięcie i staranna ocena pooperacyjna.
Wewnątrznabłonkowa neoplazja sromu
Wewnątrznabłonkowa neoplazja sromu jest hiperplastyczną zmianą płaskonabłonkową z atypią, która jest ograniczona do nabłonka. VIN dzieli się histologicznie na trzy kategorie: VIN I (dysplazja łagodna), VIN II (dysplazja umiarkowana) oraz VIN III (dysplazja ciężka i carcinoma in situ). Zmiany VIN są wystarczająco atypowe, aby uznać je za przedzłośliwe. Częstość progresji do złośliwego procesu inwazyjnego jest stosunkowo niska (10% do 15%), a czas trwania progresji może wynosić kilka lat.4
Choroba Bowena, VIN III i carcinoma in situ są klinicznie terminami synonimicznymi. Zmiany te objawiają się jako hiperkeratotyczne, uniesione, często pigmentowane zgrubienia nabłonka (ryc. 4). Zwykle występują u kobiet w szóstej dekadzie życia lub starszych, jednak młodszy wiek nie wyklucza rozpoznania. Wyniki biopsji wykazują atypię nabłonka na całej grubości i aktywność mitotyczną (ryc. 5). Miejsca dotknięte chorobą mogą być bezobjawowe lub ulegać złuszczeniu w wyniku drapania. Każda zgrubiała, uniesiona lub hiperkeratotyczna zmiana zaobserwowana podczas badania ginekologicznego powinna być rozważona do biopsji, niezależnie od towarzyszących objawów. Zmiany na sromie mogą być wieloogniskowe, dlatego zaleca się wykonanie kilku biopsji. Wzmocnienie zmian barwnikami takimi jak błękit toluidyny jest zalecane w przypadku wieloogniskowej natury tych zmian. Błękit toluidyny powinien wybarwić obszary koncentracji jądrowej, które są związane z VIN III; jednak większość zmian jest hiperkeratotyczna, a powierzchnia keratyny uniemożliwia penetrację barwnika do jąder nabłonka. Bardziej skutecznym podejściem jest zastosowanie na srom rozcieńczonego roztworu kwasu octowego. Obszary z ekspresją VIN i HPV stają się octowobiałe po kilku minutach moczenia.4 Następnie srom można obejrzeć za pomocą lupy lub kolposkopu. W ten sposób łatwiej zidentyfikować subtelne zmiany nabłonka.
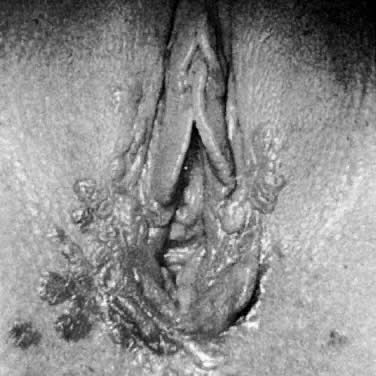 Fig. 4. Carcinoma in situ pokazujący hiperkeratotyczne pigmentowane zgrubienie nabłonka.
Fig. 4. Carcinoma in situ pokazujący hiperkeratotyczne pigmentowane zgrubienie nabłonka.
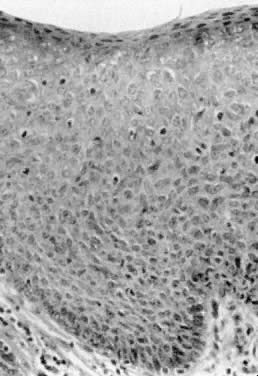 Fig. 5. Carcinoma in situ wykazujący atypię nabłonka w całej jego warstwie.
Fig. 5. Carcinoma in situ wykazujący atypię nabłonka w całej jego warstwie.
Choroba Bowena lub VIN III powinny być leczone wycięciem chirurgicznym, laserowym lub elektrycznym.4 Preferowane jest usunięcie zmiany techniką, która zapewnia dostarczenie tkanki do dalszych badań histologicznych. Stosowanie 5-FU lub interferonu systemowego ma marginalną zgodność i powodzenie.3,5 Wycięcie chirurgiczne z oceną marginesów pozostaje preferowaną opcją postępowania. Sugeruje się ścisłą obserwację w celu oceny nawrotu.
Bowenoid papillosis ma kliniczną i patologiczną prezentację, która jest podobna do VIN III. Występuje u pacjentów w drugiej, trzeciej i czwartej dekadzie życia. Objawia się jako liczne zmiany brodawkowate, które mogą obejmować więcej niż jeden obszar sromu.3,4 Zmiany te są związane z infekcjami HPV. Wyniki biopsji wykazują atypię nabłonka z koilocytotycznymi zmianami HPV. Progresja do inwazyjnego nowotworu złośliwego występuje w rzadkich przypadkach, np. u pacjentów w immunosupresji lub z obniżoną odpornością. Postępowanie jest zachowawcze, o ile nie występują zmiany przednowotworowe. Zmiany przednowotworowe leczy się w sposób podobny do VIN.
Rak podstawnokomórkowy
Raki podstawnokomórkowe zwykle są bezobjawowe, dopóki nie są wystarczająco duże, aby zostały zauważone przez pacjenta lub dopóki nie rozwinie się owrzodzenie i krwawienie. Nowotwór jest twardy, o pofałdowanych granicach i najczęściej występuje na wargach sromowych większych u kobiet po menopauzie. Przerzuty są rzadkie. Leczenie polega na szerokim wycięciu guza z zachowaniem odpowiednich marginesów. Ocena w kierunku przerzutów powinna być rozważona, jeśli wycięty fragment wykazuje inwazję podskórnej tkanki tłuszczowej, grubość guza większą niż 1 cm lub zajęcie cewki moczowej lub pochwy. Raki podstawnokomórkowe stanowią 2% do 4% łagodnych nowotworów sromu.6
Histologicznie, guzy te mają obwodowe palisadowanie komórek podstawnych na brzegach nabłonka. Pozostała część guza ma ściśle upakowane, jednolite komórki, z bazofilnymi jądrami i skąpą cytoplazmą. Figury mitotyczne są częste. Guzy te są miejscowo inwazyjne, dlatego konieczne jest dokładne zbadanie całej zmiany. W szczególności marginesy powinny być oceniane i raportowane pod kątem adekwatności. Marginesy mniejsze niż 4 mm są obarczone większym ryzykiem nawrotu.
Acrochordon
Polipy włóknisto-nabłonkowe są powszechne w nabłonku sromu. Określa się je mianem tagów skórnych. Zmiana ta nie ma potencjału złośliwego. Są to miękkie, cieliste, polipowate struktury. Wyrostki skórne i włosy nie są charakterystyczne dla akrochordonu. Terapia polega na miejscowym wycięciu zmian objawowych.
Histologicznie akrochordon jest opisywany jako włóknisto-naczyniowa szypuła z dojrzałym hiperkeratotycznym nabłonkiem płaskim. Wyrostki naskórkowe są rzadkie, a wzór naczyniowy może być wzmocniony.
Hidradenoma
Hidradenoma są guzami apokrynowych gruczołów potowych. Niektóre mogą mieć swoje źródło w gruczołach potowych ekrynowych. Zwykle mają średnicę mniejszą niż 1 cm i występują na przyśrodkowej stronie warg sromowych większych (ryc. 6). Zmiany są twarde i łatwo przesuwalne. W przypadku połączenia się zmiany z powierzchnią nabłonka może dojść do owrzodzenia i bólu. Leczenie polega na wycięciu chirurgicznym.
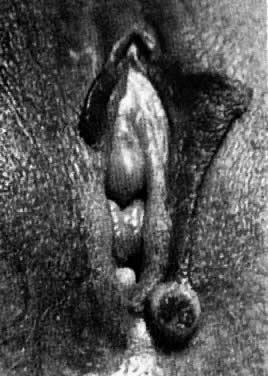 Fig. 6. Hidradenoma sromu.
Fig. 6. Hidradenoma sromu.
Histologicznie hidradenoma posiada torbielowate przestrzenie, które są wyścielone komórkami kolumnowymi. Zmiana charakteryzuje się ponadto wieloma złożonymi fałdami, brodawkowatymi strukturami i wyraźną proliferacją gruczołów (ryc. 7). Zmiana ta może być mylona z gruczolakorakiem. Cechami wyróżniającymi hidradenoma są brak pleomorfizmu, układanie się komórek w stosy oraz zgodność jądrowa.
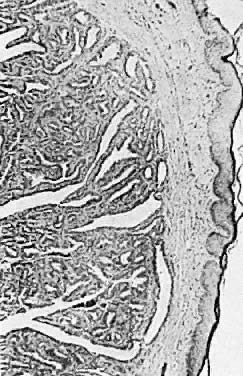 Ryc. 7. Hidradenoma of the vulva ( × 25)
Ryc. 7. Hidradenoma of the vulva ( × 25)
Syringoma
Syringoma są małymi, łagodnymi hamartoma gruczołów potowych ekrynowych. Zazwyczaj obecne są zmiany mnogie, które mogą występować w więcej niż jednym miejscu na ciele. Zmiany są bezobjawowe i nie wymagają leczenia, chyba że pojawi się ból lub świąd.7
Mikroskopowo są to guzy poszerzonych przewodów gruczołów potowych i torbiele wyścielone łagodnymi komórkami prostopadłościennymi (ryc. 8). Obecny jest minimalny odczyn zapalny, chyba że dojdzie do pęknięcia torbieli.
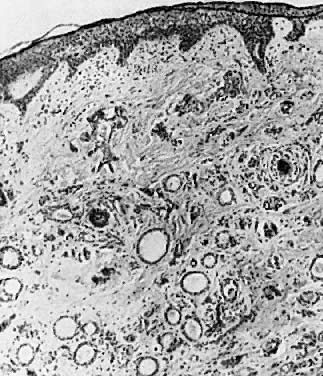 Ryc. 8 . Syringoma Widoczne są liczne poszerzone przewody gruczołów potowych ( × 35).
Ryc. 8 . Syringoma Widoczne są liczne poszerzone przewody gruczołów potowych ( × 35).
Pigmentowane guzy sromu
Pigmentowane zmiany sromu występują u 10% do 12% wszystkich kobiet. Dwa procent ma zmiany pigmentowe z cechami przednowotworowymi. Łagodne zmiany pigmentowe są klasyfikowane jako plamy soczewicowate, melanoza sromu i znamiona.
Lentiginy są małymi (1 do 4 mm), dobrze odgraniczonymi plamami. Występują one u 3% do 6% kobiet. Plamki soczewicowate są również częścią kilku zespołów obejmujących śluzaka przedsionka i inne wady strukturalne i przewodzenia serca (zespół LAMB, zespół LEOPARD).8 Nie wymagają leczenia.
Histologicznie plamki soczewicowate są podobne do znamion łącznotkankowych. Występuje hiperplazja w naskórku i zwiększona ilość melaniny w warstwie podstawnej skóry. Atypia jądrowa nie jest widoczna w hiperplastycznej tkance.
Melanoza sromowa jest zmianą, która jest większa niż lentigo i ma nieregularną granicę. Histologicznie obecne są zwiększone liczby melanocytów i melanofagów skórnych. Obecne jest odkładanie melaniny w warstwie podstawnej i nadbazalnej naskórka. Melanoza sromu i plamy soczewicowate są częścią spektrum zmian pigmentacyjnych sromu. Ważne jest, aby odróżnić je od czerniaków poprzez wykonanie biopsji reprezentatywnego obszaru.
Świądki sromowe występują u 2% kobiet. Znamiona są klasyfikowane jako śródskórne, łączące i złożone. Znamię śródskórne powstaje w skórze właściwej (ryc. 9), a znamię łączące powstaje w warstwie podstawnej naskórka (ryc. 10). Znamię złożone ma cechy zarówno znamienia śródskórnego, jak i znamienia łączącego (ryc. 11). Ocena histologiczna melanocytów pod kątem nietypowej architektury i zmian cytologicznych pozwala odróżnić znamiona barwnikowe od czerniaka. Podrażnione lub krwawiące znamiona powinny być wycięte. Wysoki indeks podejrzliwości i liberalne stosowanie wycięcia powinny być częścią schematu postępowania.
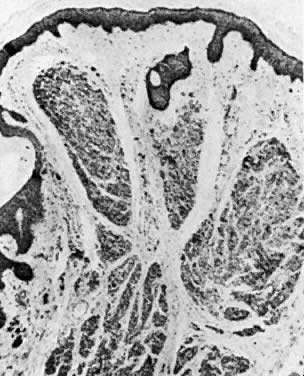 Ryc. 9. Znamię śródskórne. Komórki znamienia widoczne są w górnej skórze właściwej ( × 40)
Ryc. 9. Znamię śródskórne. Komórki znamienia widoczne są w górnej skórze właściwej ( × 40)
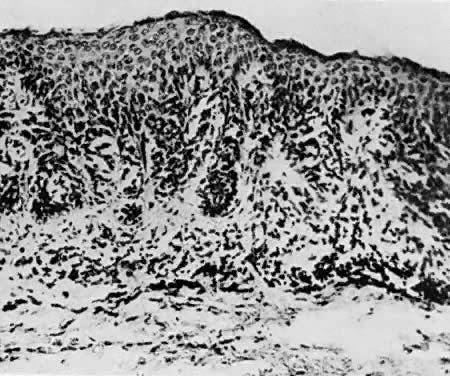 Ryc. 10. Znamię junctional nevus. Ten typ może stać się złośliwy ( × 50)
Ryc. 10. Znamię junctional nevus. Ten typ może stać się złośliwy ( × 50)
 Fig. 11. Znamię złożone. Komórki znamienia widoczne są na styku naskórka i skóry właściwej oraz w górnej części skóry właściwej (× 50)
Fig. 11. Znamię złożone. Komórki znamienia widoczne są na styku naskórka i skóry właściwej oraz w górnej części skóry właściwej (× 50)
.




