Chemia
Tworzenie się roztworu jest przykładem procesu spontanicznego, czyli takiego, który zachodzi w określonych warunkach bez potrzeby dostarczania energii z jakiegoś zewnętrznego źródła. Czasami mieszamy mieszaninę, aby przyspieszyć proces rozpuszczania, ale nie jest to konieczne; jednorodny roztwór powstałby, gdybyśmy poczekali wystarczająco długo. Zagadnienie spontaniczności jest niezwykle ważne w badaniu termodynamiki chemicznej i jest omówione bardziej szczegółowo w innym rozdziale tego tekstu. Dla celów dyskusji w tym rozdziale, wystarczy rozważyć dwa kryteria, które sprzyjają, ale nie gwarantują, spontanicznego tworzenia się roztworu:
- zmniejszenie energii wewnętrznej układu (zmiana egzotermiczna, omówiona w poprzednim rozdziale o termochemii)
- wzrost nieporządku w układzie (co wskazuje na wzrost entropii układu, o czym dowiesz się w późniejszym rozdziale o termodynamice)
W procesie rozpuszczania często, ale nie zawsze, następuje zmiana energii wewnętrznej, ponieważ ciepło jest pochłaniane lub wydzielane. Wzrost nieporządku jest zawsze wynikiem tworzenia się roztworu.
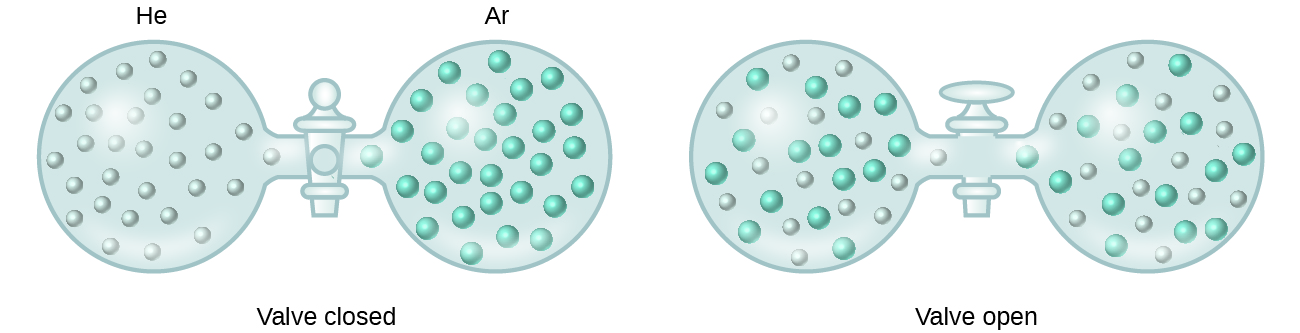
Gdy siły przyciągania międzycząsteczkowego pomiędzy solutem i rozpuszczalnikiem w roztworze nie różnią się od sił występujących w oddzielonych składnikach, roztwór tworzy się bez towarzyszącej zmiany energii. Roztwór taki nazywany jest roztworem idealnym. Mieszanina gazów idealnych (lub gazów takich jak hel i argon, które są bliskie idealnego zachowania) jest przykładem roztworu idealnego, ponieważ jednostki składające się na te gazy nie doświadczają znaczących atrakcji międzycząsteczkowych.
Gdy pojemniki z helem i argonem są połączone, gazy spontanicznie mieszają się w wyniku dyfuzji i tworzą roztwór (rysunek 2). Tworzenie się tego roztworu wyraźnie wiąże się ze wzrostem nieuporządkowania, ponieważ atomy helu i argonu zajmują objętość dwukrotnie większą od tej, którą każdy z nich zajmował przed zmieszaniem.
Roztwory idealne mogą również powstawać, gdy ciecze o podobnej strukturze są mieszane. Na przykład, mieszaniny alkoholi metanolu (CH3OH) i etanolu (C2H5OH) tworzą roztwory idealne, podobnie jak mieszaniny węglowodorów pentanu, C5H12, i heksanu, C6H14. Umieszczenie metanolu i etanolu, lub pentanu i heksanu, w bańkach pokazanych na rysunku 2 spowoduje taką samą dyfuzję i późniejsze mieszanie się tych cieczy, jaką obserwuje się dla gazów He i Ar (choć w znacznie wolniejszym tempie), dając roztwory bez znaczącej zmiany energii. Jednak w przeciwieństwie do mieszaniny gazów, na składniki roztworów ciecz-ciecz działają międzycząsteczkowe siły przyciągania. Ale ponieważ cząsteczki dwóch mieszanych substancji są strukturalnie bardzo podobne, międzycząsteczkowe siły przyciągania pomiędzy podobnymi i niepodobnymi cząsteczkami są zasadniczo takie same, a zatem proces rozpuszczania nie pociąga za sobą żadnego zauważalnego wzrostu lub spadku energii. Przykłady te ilustrują, w jaki sposób sama dyfuzja może zapewnić siłę napędową wymaganą do spowodowania spontanicznego tworzenia się roztworu. W niektórych przypadkach, jednakże, względne wielkości międzycząsteczkowych sił przyciągania pomiędzy rozpuszczalnikiem a gatunkami rozpuszczalnika mogą zapobiec rozpuszczeniu.
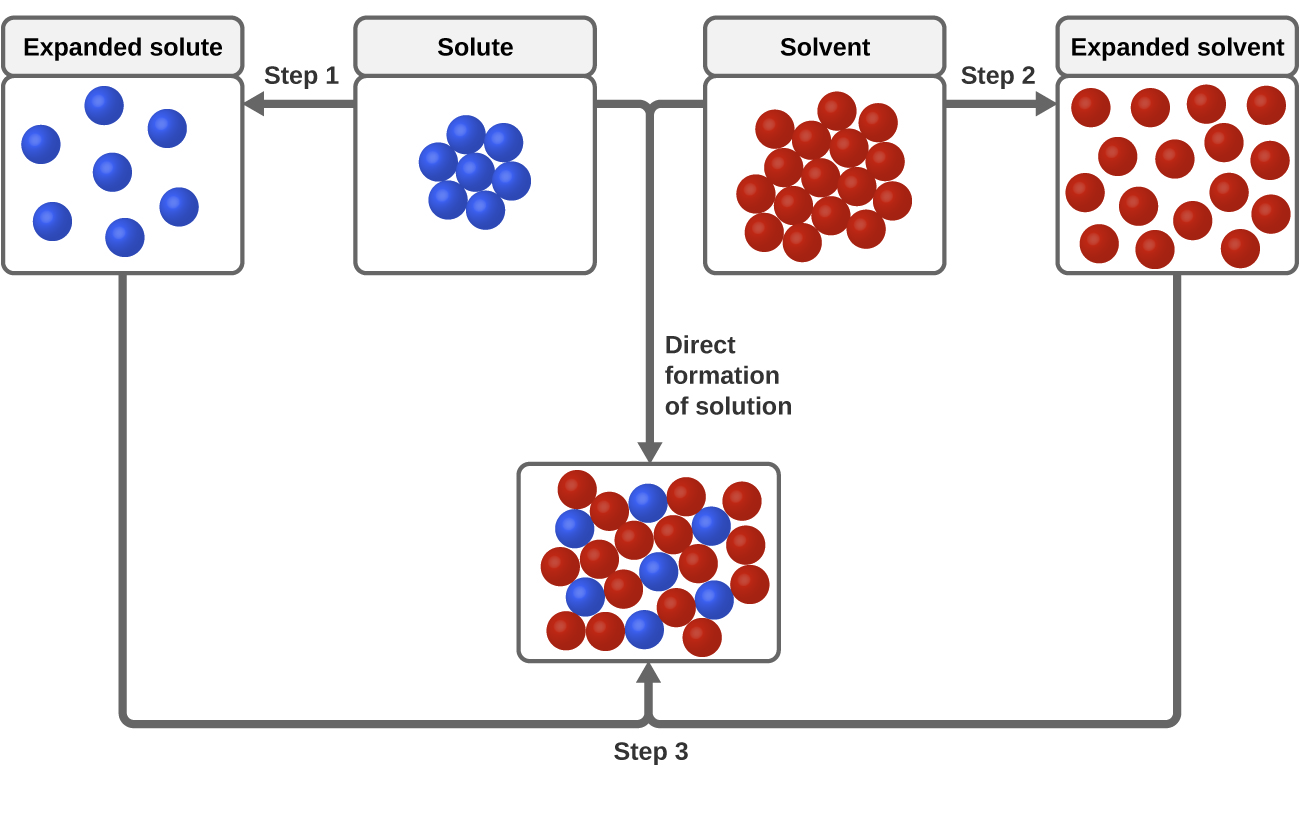
Trzy rodzaje międzycząsteczkowych sił przyciągania są istotne dla procesu rozpuszczania: rozpuszczalnik-rozpuszczalnik, rozpuszczalnik-rozpuszczalnik i rozpuszczalnik-rozpuszczalnik. Jak pokazano na rysunku 3, tworzenie roztworu może być postrzegane jako stopniowy proces, w którym energia jest zużywana na przezwyciężenie przyciągania rozpuszczalnik-rozpuszczalnik i rozpuszczalnik-rozpuszczalnik (procesy endotermiczne) i uwalniana, gdy przyciąganie rozpuszczalnik-rozpuszczalnik zostaje ustanowione (proces egzotermiczny zwany solwatacją). Względne wielkości zmian energii związane z tymi stopniowymi procesami określają, czy proces rozpuszczania będzie uwalniał czy pochłaniał energię. W niektórych przypadkach roztwory nie tworzą się, ponieważ energia wymagana do oddzielenia rozpuszczalnika i rozpuszczalnika jest znacznie większa niż energia uwolniona w procesie solwatacji.
Na przykład, oleje spożywcze i woda nie będą mieszać się w żadnym znaczącym stopniu, aby uzyskać roztwory (rysunek 4). Wiązanie wodorowe jest dominującą międzycząsteczkową siłą przyciągającą obecną w ciekłej wodzie; niepolarne cząsteczki węglowodorów w olejach spożywczych nie są zdolne do wiązania wodorowego, zamiast tego są trzymane razem przez siły dyspersji. Utworzenie roztworu olej-woda wymagałoby pokonania bardzo silnego wiązania wodorowego w wodzie, jak również znacznie silniejszych sił dyspersji pomiędzy stosunkowo dużymi cząsteczkami oleju. A ponieważ polarne cząsteczki wody i niepolarne cząsteczki oleju nie doświadczyłyby bardzo silnego przyciągania międzycząsteczkowego, bardzo mało energii zostałoby uwolnione w wyniku solwatacji.

Z drugiej strony, mieszanina etanolu i wody zmiesza się w dowolnych proporcjach, dając roztwór. W tym przypadku, obie substancje są zdolne do wiązania wodorowego, a więc proces solwatacji jest wystarczająco egzotermiczny, aby skompensować endotermiczne oddzielenie cząsteczek solutu i rozpuszczalnika.
Jak zauważono na początku tego modułu, spontaniczne tworzenie się roztworu jest preferowane, ale nie gwarantowane, przez egzotermiczne procesy rozpuszczania. Podczas gdy wiele rozpuszczalnych związków rzeczywiście rozpuszcza się z wydzieleniem ciepła, niektóre rozpuszczają się endotermicznie. Azotan amonu (NH4NO3) jest jednym z takich przykładów i jest używany do produkcji natychmiastowych zimnych okładów do leczenia urazów, takich jak ten przedstawiony na Rysunku 5. Cienkościenna plastikowa torebka z wodą jest zamknięta wewnątrz większej torebki ze stałym NH4NO3. Kiedy mniejsza torebka jest pęknięta, tworzy się roztwór NH4NO3, absorbując ciepło z otoczenia (zraniony obszar, do którego przykłada się okład) i zapewniając zimny kompres, który zmniejsza obrzęk. Rozpuszczenia endotermiczne, takie jak to, wymagają większego nakładu energii do oddzielenia gatunków solutu niż jest to odzyskiwane, gdy soluty są rozpuszczane, ale są one spontaniczne mimo wszystko ze względu na wzrost nieuporządkowania, który towarzyszy tworzeniu się roztworu.


Zobacz ten krótki film ilustrujący endotermiczne i egzotermiczne procesy rozpuszczania.
Kluczowe pojęcia i podsumowanie
Roztwór tworzy się, gdy dwie lub więcej substancji łączy się fizycznie, dając mieszaninę, która jest jednorodna na poziomie molekularnym. Rozpuszczalnik jest najbardziej stężonym składnikiem i określa stan fizyczny roztworu. Rozpuszczalniki to pozostałe składniki, które zazwyczaj występują w stężeniach niższych niż stężenia rozpuszczalnika. Roztwory mogą powstawać endotermicznie lub egzotermicznie, w zależności od względnej wielkości międzycząsteczkowych sił przyciągania solutu i rozpuszczalnika. Roztwory idealne tworzą się bez zauważalnej zmiany energii.
Chemia Ćwiczenia na koniec rozdziału
- Czym różnią się roztwory od związków? Od innych mieszanin?
- Które z głównych cech roztworów możemy zaobserwować w roztworach K2Cr2O7 pokazanych na rysunku 1?
- Gdy KNO3 rozpuszcza się w wodzie, otrzymany roztwór jest znacznie zimniejszy niż woda pierwotnie.
(a) Czy rozpuszczanie KNO3 jest procesem endo- czy egzotermicznym?
(b) Jakie wnioski możesz wyciągnąć na temat atrakcji międzycząsteczkowych biorących udział w tym procesie?
(c) Czy otrzymany roztwór jest roztworem idealnym?
- Podaj przykład każdego z poniższych typów roztworów:
(a) gaz w cieczy
(b) gaz w gazie
(c) ciało stałe w ciele stałym
- Wskaż najważniejsze rodzaje atrakcji międzycząsteczkowych w każdym z poniższych roztworów:
(a) Roztwór z rysunku 1.
(b) NO(l) w CO(l)
(c) Cl2(g) w Br2(l)
(d) HCl(aq) w benzenie C6H6(l)
(e) Metanol CH3OH(l) w H2O(l)
.
- Przewidź, czy każda z następujących substancji byłaby bardziej rozpuszczalna w wodzie (rozpuszczalnik polarny), czy w węglowodorze takim jak heptan (C7H16, rozpuszczalnik niepolarny):
(a) olej roślinny (niepolarny)
(b) alkohol izopropylowy (polarny)
(c) bromek potasu (jonowy)
- Ciepło jest uwalniane, gdy tworzą się niektóre roztwory; ciepło jest pochłaniane, gdy tworzą się inne roztwory. Podaj molekularne wyjaśnienie różnicy pomiędzy tymi dwoma rodzajami spontanicznych procesów.
- Roztwory wodoru w palladzie mogą powstawać poprzez wystawienie metalu Pd na działanie gazu H2. Stężenie wodoru w palladzie zależy od ciśnienia gazu H2, ale w bardziej złożony sposób niż można to opisać prawem Henry’ego. W pewnych warunkach 0,94 g wodoru gazowego rozpuszcza się w 215 g metalu palladu.
(a) Określić molowość tego roztworu (gęstość roztworu = 1,8 g/cm3).
(b) Określić molowość tego roztworu (gęstość roztworu = 1,8 g/cm3).
(c) Określić procent masowy atomów wodoru w tym roztworze (gęstość roztworu = 1,8 g/cm3).
.




