CNIO, nowe kroki w kierunku przyszłej terapii przeciwko zwłóknieniu płuc związanemu z wiekiem
Grupa ds. Telomerów i Telomerazy w hiszpańskim Narodowym Centrum Badań nad Rakiem (CNIO) zademonstrowała skuteczną terapię u myszy ze zwłóknieniem spowodowanym starzeniem się, po opracowaniu takiego samego leku dla myszy ze zwłóknieniem spowodowanym wadami genetycznymi. Badanie, opublikowane w Journal of Cell Biology, rozwija terapię genową, która aktywuje produkcję telomerazy w organizmie.
Idiopatyczne włóknienie płuc jest nieleczoną i potencjalnie śmiertelną chorobą związaną z pewnymi mutacjami, a także z procesem starzenia się.
Telomeraza jest enzymem odpowiedzialnym za naprawę końców chromosomów, gdzie znajdują się telomery. Terapia okazała się wysoce skuteczna u zwierząt i nie zaobserwowano żadnych skutków ubocznych. Wyjaśniła to prowadząca badanie Maria Blaso.
„Jeśli myślimy o ludziach, nasz wynik wskazuje na możliwość stworzenia terapii zdolnej do zapobiegania rozwojowi zwłóknienia płuc związanego ze starzeniem się u każdego pacjenta”, mówi Blasco.
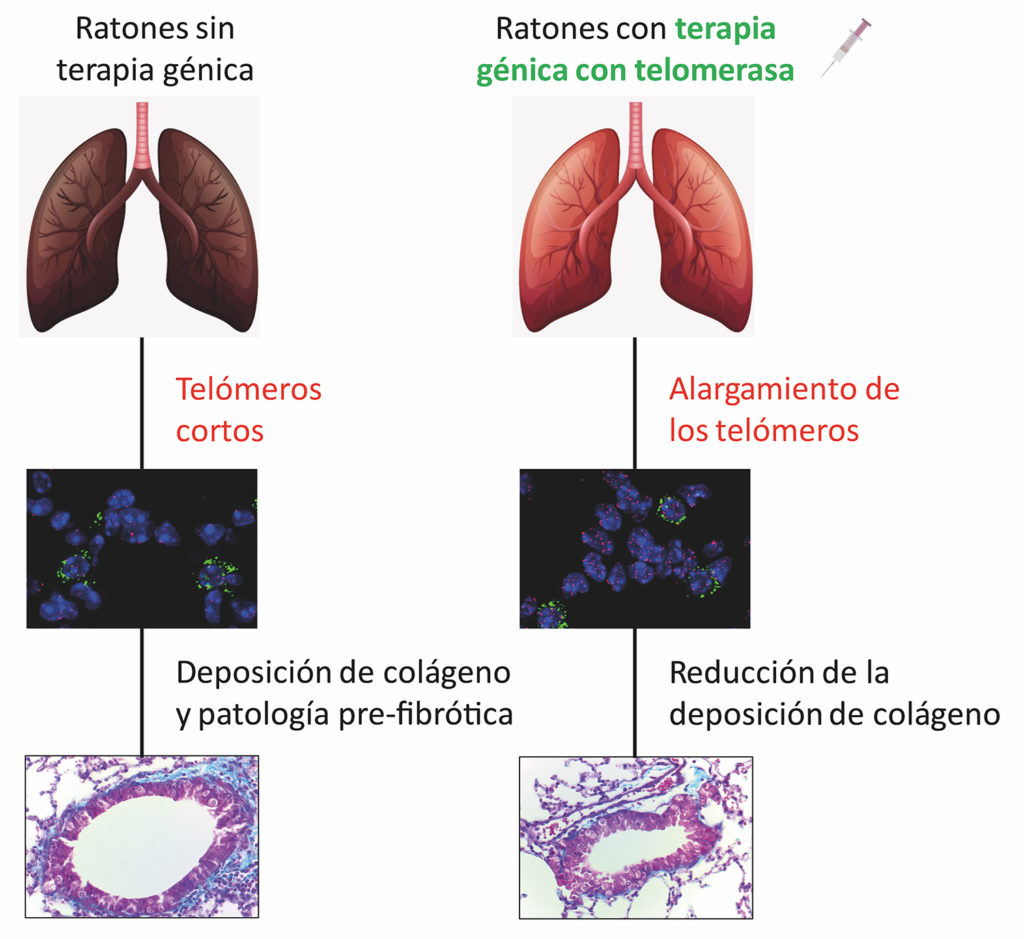
Dysfunkcja telomerów u źródeł zwłóknienia
Włóknienie płuc dotyka około 8000 osób w Hiszpanii. W tej chorobie tkanka płucna ulega bliznowaceniu i staje się sztywna, co prowadzi do stopniowej utraty zdolności do oddychania.
Jej przyczyny przypisuje się kombinacji genetyki i środowiska: toksyny środowiskowe odgrywają ważną rolę, ale aby choroba mogła się ujawnić, musi być również albo przyczyna genetyczna, albo starzenie się związane z upływem czasu.
Grupa CNIO wykazała już w poprzednich badaniach, że ta genetyczna przyczyna leży w nieprawidłowym funkcjonowaniu telomerów. Telomery to struktury, które, podobnie jak czapeczki, chronią integralność chromosomów obecnych we wszystkich komórkach.
W 2015 roku stworzyli zwierzęcy model zwłóknienia płuc, mysz, której brakuje genu telomerazy. U tych zwierząt komórki odpowiedzialne za regenerację tkanki płucnej, zwane pneumocytami pęcherzykowymi typu II, w końcu obumierają z powodu dysfunkcji telomerów. W rezultacie u myszy dochodzi do agresywnego zwłóknienia, ponieważ nabłonek jej płuc nie może się okresowo odnawiać. To właśnie ta okresowa regeneracja utrzymuje tkanki w zdrowiu, wolne od uszkodzeń spowodowanych toksynami środowiskowymi.
Włóknienie związane ze starzeniem się
Ten model zwierzęcy bez genu telomerazy dobrze odtwarza to, co dzieje się u pacjentów, u których włóknienie jest spowodowane mutacjami wpływającymi na telomery. Ale ci ludzie są w mniejszości. U zdecydowanej większości pacjentów nic nie wskazuje na konkretną mutację, ale jest jeden czynnik wspólny dla nich wszystkich: zaawansowany wiek.

Telomery mogą również stracić swoją funkcję przez sam proces starzenia się. Badania nad tym, jak to się dzieje, to dziedzina prowadzona na arenie międzynarodowej przez grupę Blasco.
Telomery są czapki białka na końcach chromosomów, a oni się trochę krótszy za każdym razem komórka dzieli. Biorąc to pod uwagę, po wielu podziałach komórkowych w ciągu życia organizmu przychodzi moment, kiedy stają się one tak krótkie, że tracą swoją zdolność do ochrony chromosomów. Komórka interpretuje to jako błąd i przestaje się dzielić, więc tkanka nie regeneruje się.
W opublikowanej teraz pracy badacze wykazali, że ta związana z wiekiem dysfunkcja telomerów rzeczywiście występuje w regenerujących się komórkach tkanki płucnej, pneumocytach typu II. W ten sposób znajdują molekularną przyczynę związku między starzeniem się i zwłóknieniem płuc, tak wyraźną w klinice.
Utrata smaru w płucach
Według autorów „jednym z osiągnięć nowej pracy jest bardzo szczegółowe opisanie wpływu starzenia się na tkankę płucną”. „Jeden z nich wywodzi się bezpośrednio z faktu, że pneumocyty typu II przestają wykonywać swoją pracę”, mówi Sergio Piñeiro, pierwszy autor pracy.
Oprócz regeneracji tkanki, komórki te wytwarzają i uwalniają płyn, który ułatwia mechaniczną pracę płuc, tzw. surfaktant płucny.
„Tkanka płucna musi się otwierać przy każdym oddechu, od sześciu do dziesięciu razy na minutę, co z fizycznego punktu widzenia jest ogromnym wysiłkiem”, wyjaśnia Jesús Pérez-Gil, ekspert z Uniwersytetu Complutense w Madrycie.
Gil, który współpracował w badaniu i którego zespół jest ekspertem w tej dziedzinie, zwraca uwagę, że „surfaktant płucny jest niezbędny do smarowania tkanki, umożliwiając jej otwieranie i zamykanie z minimalnym wysiłkiem i utrzymując jej elastyczność”.
„Jeśli pneumocyty typu II nie regenerują się, ani nie surfaktant, a to przyczynia się do płuc staje się stopniowo sztywne, zwłóknienie”
Complutense University of Madrid, Jesús Pérez-Gil
W tej pracy „zaobserwowaliśmy bardzo wyraźny związek między statusem telomerów pneumocytów typu II, płucnej produkcji surfaktantu i rozwoju zwłóknienia u zwierząt”, dodaje Pérez-Gil. „W tej współpracy zajmujemy się w połączony sposób skutkami w skali molekularnej, na telomerach; biologicznymi i fizycznymi zmianami w komórkach i tkankach; oraz konsekwencjami dla zdrowia zwierzęcia, całego organizmu.”
Terapia dla wszystkich rodzajów zwłóknienia
W 2018 roku grupa CNIO opracowała terapię genową zdolną do leczenia zwłóknienia, które rozwinęły ich myszy pozbawione genu telomerazy. Leczenie polega na odwróceniu tej mutacji genetycznej, czasowo aktywując syntezę telomerazy u myszy.

Myszy podaje się dożylnie wirus, którego jedyną funkcją jest przenoszenie genu telomerazy do tkanek. Jego działanie jest krótkotrwałe, ale wystarczy, by pneumocyty typu II odrastały z długimi telomerami, a tkanka płucna regenerowała się.
Teraz zastosowali tę samą terapię na myszach, które po prostu się starzeją. I to też działa. Leczenie terapią genową aktywującą telomerazę zapobiegło wystąpieniu zwłóknienia u wszystkich myszy, również tych, które nie miały zmian genetycznych, ale starzały się fizjologicznie”, wyjaśnia Blasco.
Rozszerza to możliwość wyleczenia zwłóknienia płuc na prawie wszystkie przypadki zwłóknienia, jak podsumowują badacze w swoim artykule: „Odkrycia te pomagają wyjaśnić znaczenie telomerazy dla przyszłych strategii terapeutycznych przeciwko idiopatycznemu zwłóknieniu płuc”.
Badanie zostało sfinansowane przez hiszpańskie Ministerstwo Nauki, Innowacji i Uniwersytetów, Instytut Zdrowia Carlosa III, Wspólnotę Madrytu, Fundację Botín i Banco Santander poprzez Santander Universities i World Cancer Research.
Badanie zostało sfinansowane przez hiszpańskie Ministerstwo Nauki, Innowacji i Uniwersytetów, Instytut Zdrowia Carlosa III, Wspólnotę Madrytu, Fundację Botín i Banco Santander poprzez Santander Universities i World Cancer Research.




