Fakty na temat baru
Nazywany po greckim słowie barys oznaczającym „ciężki”, bar jest stosunkowo gęstym i reaktywnym metalem ziem alkalicznych. Występuje naturalnie tylko w połączeniu z innymi pierwiastkami, a związki zawierające bar mają szeroki zakres zastosowań; można je znaleźć w trutce na szczury, środkach obciążających w płynach do wierceń naftowych oraz w białym płynie używanym do wizualizacji jelit w rentgenowskim badaniu diagnostycznym zwanym lewatywą barową.
Same fakty
- Liczba atomowa (liczba protonów w jądrze): 56
- Symbol atomowy (w układzie okresowym pierwiastków): Ba
- Waga atomowa (średnia masa atomu): 137,327
- Gęstość: 2,09 uncji na cal sześcienny (3.62 gramy na cm sześcienny)
- Faza w temperaturze pokojowej: stała
- Temperatura topnienia: 1,341 stopni Fahrenheita (727 stopni Celsjusza)
- Temperatura wrzenia: 3,447 F (1,897 C)
- Liczba izotopów naturalnych (atomy tego samego pierwiastka z różną liczbą neutronów): 7
- Najczęściej występujący izotop: Ba-138
Odkrycie baru
Vincenzo Casciarolo, XVII-wieczny włoski alchemik, po raz pierwszy zauważył bar w postaci niezwykłych kamyków, które świeciły przez lata po wystawieniu na działanie ciepła, według Royal Society of Chemistry. Nazwał je po swoim rodzinnym mieście „kamieniami bolońskimi”, ale później okazało się, że są one siarczanem baru (BaSO4). Pod koniec XVIII wieku, tlenek baru (BaO) i węglan baru (BaCO3) zostały odkryte przez niemieckiego chemika Carla Scheele i angielskiego chemika Williama Witheringa, odpowiednio.
Czysty metal baru nie został wyizolowany i zidentyfikowany do 1808 roku w Royal Institution w Londynie. Wybitny chemik i wynalazca Sir Humphry Davy użył elektrolizy do oddzielenia baru od stopionych soli baru, takich jak wodorotlenek baru (Ba(OH)2). Podczas elektrolizy, prąd elektryczny przepływa przez substancję jonową w celu oddzielenia jonów od siebie. Ponieważ sole baru były stopione, jony baru łatwo przemieszczały się do pojemnika z elektrodą ujemną, a inne jony ujemne łatwo przemieszczały się w przeciwnym kierunku do pojemnika z elektrodą dodatnią.
Źródła baru
Bar występuje naturalnie tylko w połączeniu z innymi pierwiastkami ze względu na jego wysoki poziom reaktywności. Baru jest najczęściej spotykane w połączeniu z siarczanu i węglanu, ale może również tworzyć związki z wodorotlenku, chlorku, azotanu, chloranu i innych jonów ujemnych. Około 0,05 procent skorupy ziemskiej jest bar, co czyni go 17. najbardziej obfitym elementem w skorupie, według Roberta E. Krebsa w jego książce „The History and Use of Our Earth’s Chemical Elements: A Reference Guide” (Greenwood Publishing Group, 2006). Rezerwy górnicze w Wielkiej Brytanii, Włoszech, Czechach, Stanach Zjednoczonych i Niemczech zawierają ponad 400 milionów ton baru, jak podaje John Emsley w swojej książce „Nature’s Building Blocks: An A-Z Guide to the Elements” (Oxford University Press, 1999).
W celu uzyskania czystego baru elementarnego, musi być oddzielony od innych elementów obecnych w naturalnie występujących związków baru. Bar może być ekstrahowany z chlorku baru poprzez elektrolizę. Bar można również uzyskać poprzez redukcję tlenku baru przy użyciu aluminium lub krzemu w próżni o wysokiej temperaturze i niskim ciśnieniu.
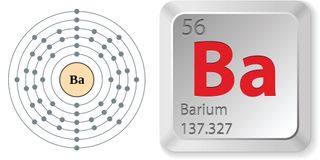
Właściwości baru
Czysty bar jest miękkim, srebrzystobiałym metalem. Sklasyfikowany jako metal ziem alkalicznych, znajduje się w grupie lub kolumnie 2 na tablicy okresowej, wraz z berylu, magnezu, wapnia, strontu i radu. Każdy z ich atomów zawiera dwa elektrony walencyjne (skrajne). Bar jest w okresie, lub rząd, 5, więc trzyma swoje elektrony walencyjne w piątej powłoki i może stracić elektrony, lub utlenia się, bardzo łatwo. To stanowi o wysokim poziomie reaktywności baru, zwłaszcza z elektronegatywnych elementów, takich jak tlen.
Komercyjne zastosowania baru
Elementarny bar nie ma wielu praktycznych zastosowań, ponownie ze względu na jego wysoki poziom reaktywności. Jednak jego silne przyciąganie do tlenu czyni go użytecznym jako „getter”, aby usunąć ostatnie ślady powietrza w lampach próżniowych. Czysty bar może być również łączony z innymi metalami, tworząc stopy, które są wykorzystywane do produkcji elementów maszyn, takich jak łożyska lub świece zapłonowe w silnikach spalinowych. Ponieważ bar ma luźny uchwyt na swoich elektronów, jego stopy emitują elektrony łatwo po podgrzaniu i poprawić wydajność świec zapłonowych, według Krebs.
Związki zawierające bar mają wiele zastosowań komercyjnych. Siarczan baru, lub baryt, jest używany w litopon (pigment rozjaśniający w papierze drukarskim i farbie), płyny do wiercenia szybów naftowych, produkcji szkła i tworzenia gumy. Węglan baru jest używany jako trucizna na szczury, a azotan baru i chloran baru wytwarzają zielone kolory w fajerwerkach.
Bar w twoim ciele
Przeciętna osoba dorosła zawiera około 22 mg baru, ponieważ jest on obecny w żywności, takiej jak marchew, cebula, sałata, fasola i ziarna zbóż. Poziom baru w zębach może faktycznie pomóc naukowcom określić, kiedy dzieci przechodzą od karmienia piersią do spożywania pokarmów stałych. Te niskie poziomy baru nie odgrywają żadnej roli biologicznej i nie są szkodliwe.
Jednakże duże ilości rozpuszczalnych soli baru mogą być toksyczne, a nawet śmiertelne, według Johna Emsleya w jego książce „The Elements of Murder: A History of Poison” (Oxford University Press, 2005). Bar może powodować wymioty, kolkę, biegunkę, drgawki i paraliż. Doszło do kilku morderstw z użyciem związków baru, w tym zabójstwa mężczyzny w Mansfield w Teksasie w 1994 r. przez jego 16-letnią córkę, Marie Robards, która ukradła octan baru z laboratorium chemicznego w szkole średniej. Kilku pacjentów zostało również przypadkowo zabitych przez bar, gdy rozpuszczalny węglan baru zamiast nierozpuszczalnego siarczanu baru został omyłkowo użyty podczas gastroenterologicznego (GI) testu diagnostycznego zwanego lewatywą barową.
Lekarze wykonują lewatywy barowe w celu uwidocznienia i zdiagnozowania nieprawidłowości jelita grubego i odbytnicy, zgodnie z Johns Hopkins Medicine. Podczas procedury, siarczan baru jest wstrzykiwany przez odbytnicę, aby pokryć wewnętrzne ściany jelita grubego. Powietrze jest zwykle podawany następnie, aby upewnić się, że powłoka baru wypełnia wszystkie nieprawidłowości powierzchni. Następnie wykorzystuje się promieniowanie rentgenowskie w celu uzyskania obrazu dolnego odcinka przewodu pokarmowego. Siarczan baru pochłania promieniowanie rentgenowskie i pojawia się na kliszy rentgenowskiej w kolorze białym, w przeciwieństwie do powietrza i otaczającej tkanki, które wydają się czarne. Analiza obrazu rentgenowskiego z lewatywy barowej pozwala lekarzom zdiagnozować zaburzenia takie jak wrzodziejące zapalenie jelita grubego, choroba Leśniowskiego-Crohna, polipy, rak i zespół jelita drażliwego.
.




